Содержание
- 2. План: 1. Количественный состав растворов. Типы концентраций. 2. Коллигативные свойства.
- 3. Важнейшим биогенным растворителем является вода. Вода - самое распространенное на Земле вещество. Общий объем воды в
- 4. По отношению к воде различают гидрофильные и гидрофобные вещества. По агрегатному состоянию растворы классифицируются на: ∙
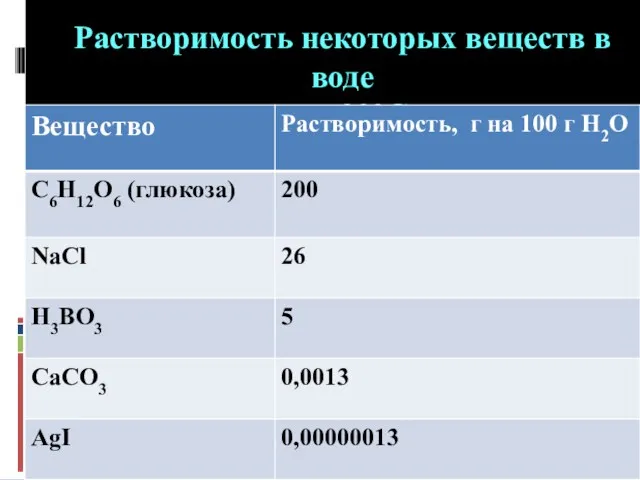
- 5. Растворимость некоторых веществ в воде при 20°С
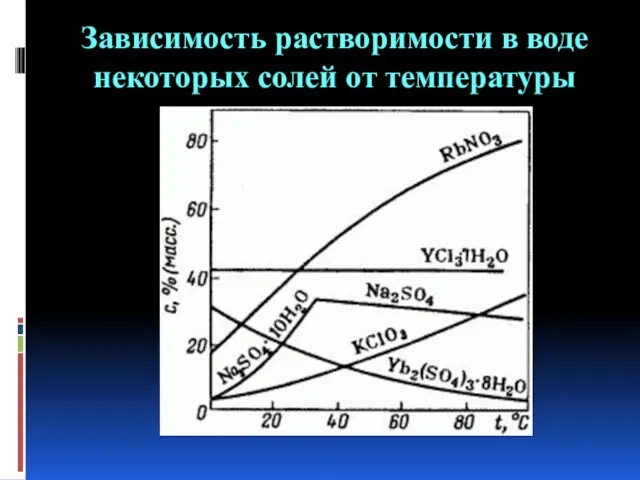
- 6. Зависимость растворимости в воде некоторых солей от температуры
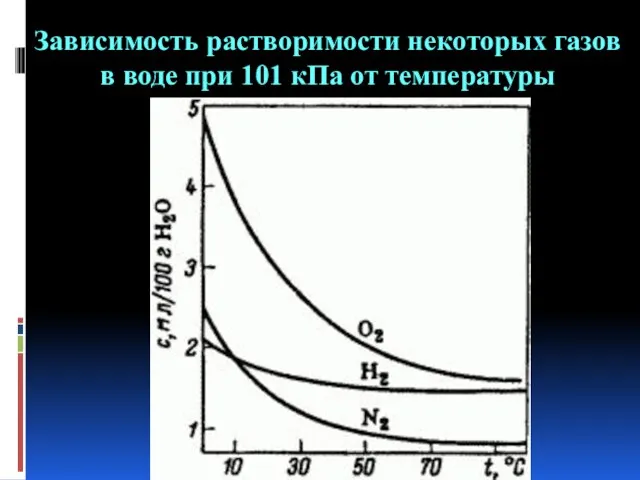
- 7. Зависимость растворимости некоторых газов в воде при 101 кПа от температуры
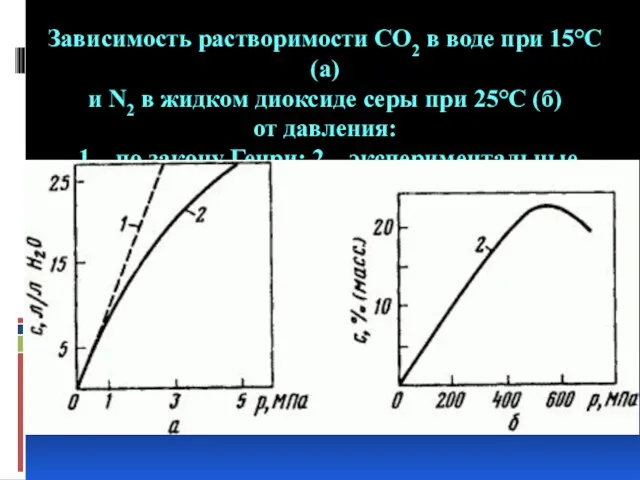
- 8. Зависимость растворимости СO2 в воде при 15°С (a) и N2 в жидком диоксиде серы при 25°С
- 9. Растворение - самопроизвольный процесс, поэтому ΔGрастворения
- 10. Например, при растворении гидроксида калия в воде наблюдается сильное разогревание раствора. KOH + ag = KOH
- 11. 1. Количественный состав растворов. Типы концентраций. Содержание компонентов в растворе может непрерывно изменяться в некоторых пределах.
- 12. Массовая доля вещества (ω) – отношение массы данного вещества m(х) в растворе к массе всего раствора
- 13. Молярная доля растворённого вещества (χ) численно равна отношению химического количества растворённого вещества к суммарному числу моль
- 14. Моляльность раствора (b или Сm) – это число молей растворенного вещества в 1000 г растворителя. b(x)
- 15. 2. Коллигативные свойства Коллигативными свойствами называются свойства растворов, которые не зависят от природы частиц растворенного вещества,
- 16. Коллигативными свойствами растворов являются: диффузия, осмос, осмотическое давление; давление насыщенного пара растворителя над раствором; температура кристаллизации
- 17. Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного вещества и растворителя, который осуществляется от
- 18. Количество вещества, переносимого за счет диффузии через единичную площадь поверхности в единицу времени, называется скоростью диффузии.
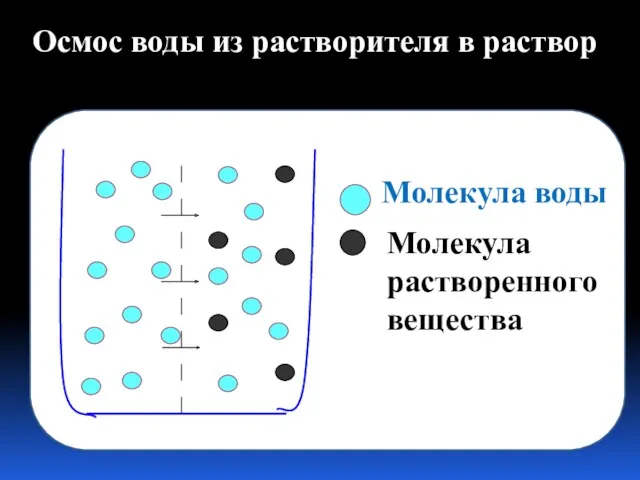
- 19. Осмос – это односторонняя диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью, разделяющую раствор и чистый
- 20. Молекула воды Молекула растворенного вещества Осмос воды из растворителя в раствор
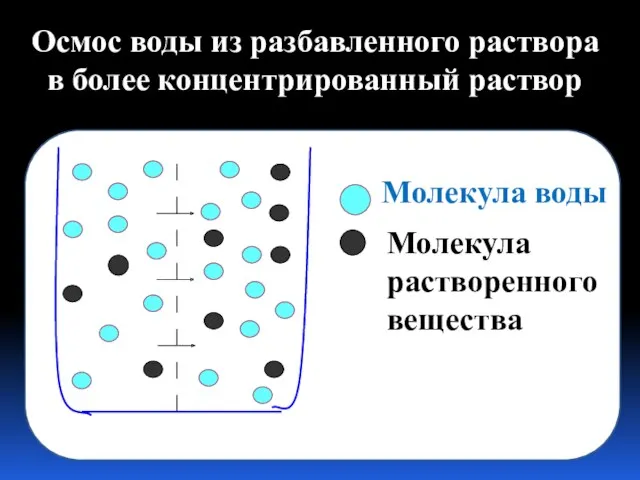
- 21. Молекула воды Молекула растворенного вещества Осмос воды из разбавленного раствора в более концентрированный раствор
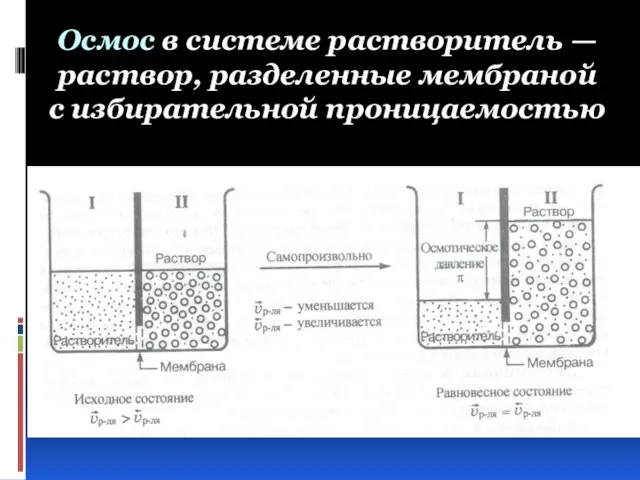
- 22. Осмос в системе растворитель — раствор, разделенные мембраной с избирательной проницаемостью
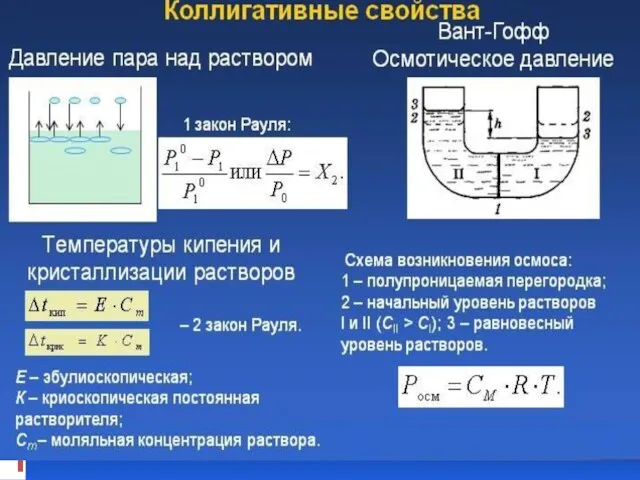
- 23. Осмотическим давлением (π(Росм)) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей
- 24. Прибор для определения осмотического давления
- 25. Осмотическая ячейка - это система, отделенная от окружающей среды мембраной с избирательной проницаемостью. Все клетки живых
- 26. ЭНДООСМОС - движение растворителя в осмотическую ячейку из окружающей среды. Условие эндоосмоса: Снар
- 27. В результате эндоосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки называемого
- 28. ЭКЗООСМОС – движение растворителя из осмотической ячейки в окружающую среду. Условие экзоосмоса: Снар>Свн (πнар> πвн).
- 29. В результате экзоосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки,
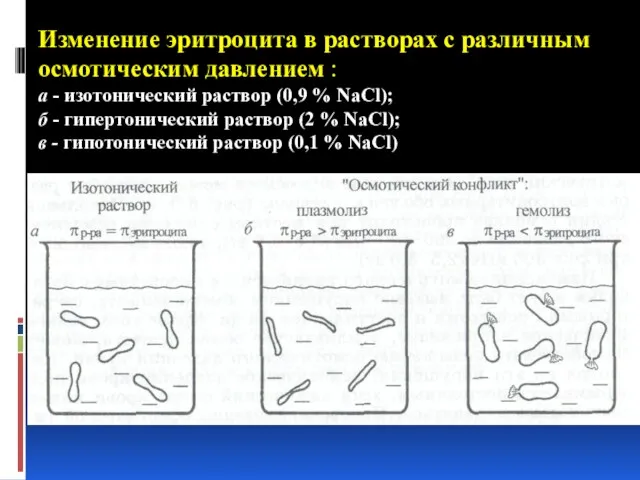
- 30. Растворы, которые имеют одинаковое осмотическое давление, называются изотоническими по отношению друг к другу. Если два раствора
- 31. Изменение эритроцита в растворах с различным осмотическим давлением : а - изотонический раствор (0,9 % NaCl);
- 32. Давление насыщенного пара над раствором Давление пара, при котором при данной температуре в системе жидкость -
- 33. Устанавливается динамическое физико-химическое равновесие, при котором число молекул, переходящих в единицу времени с единицы поверхности в
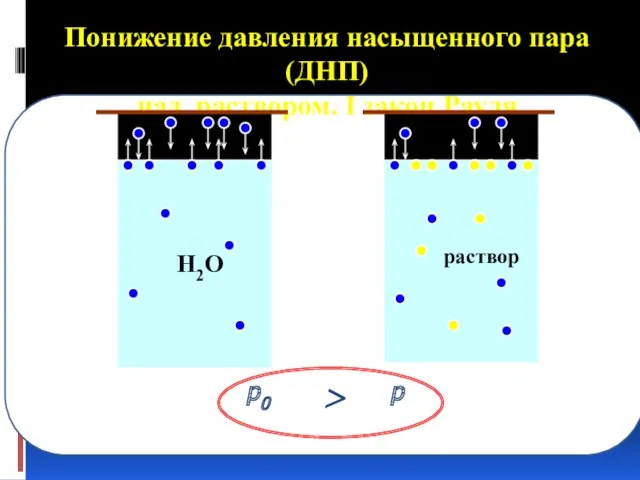
- 34. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля p0 p >
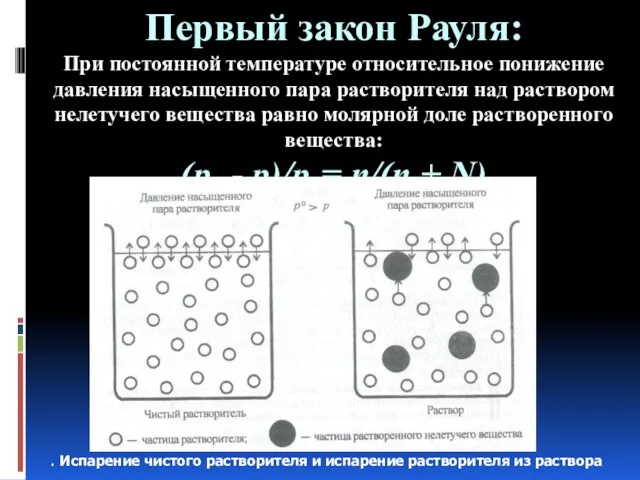
- 35. Первый закон Рауля: При постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества
- 36. Под стеклянный колпак ставят стакан с растворителем и другой стакан с таким же количеством раствора. Спустя
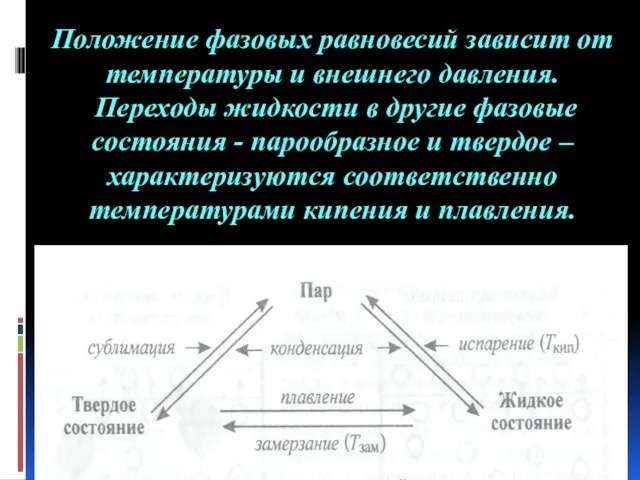
- 37. Положение фазовых равновесий зависит от температуры и внешнего давления. Переходы жидкости в другие фазовые состояния -
- 38. Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему
- 39. Температура замерзания жидкости - это температура, при которой давление насыщенного пара над жидкостью становится равным давлению
- 40. Второй закон Рауля: Повышение температуры кипения или понижение температуры замерзания растворов нелетучих веществ прямо пропорционально моляльной
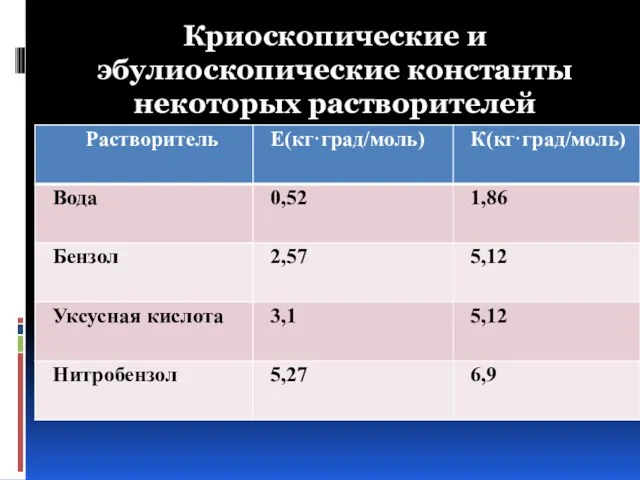
- 41. Криоскопические и эбулиоскопические константы некоторых растворителей
- 42. Эбулиоскопия и криоскопия - это методы, позволяющие экспериментально определить молярные массы растворенных веществ, а также некоторые
- 43. Схема криоскопа 1 - пробирка с боковым отростком, плотно закрытая пробкой 2-термометр (шкала от-5 до+30°С, цена
- 44. Для учета межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический коэффициент i. Для молекул растворенного
- 45. При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию
- 46. Для сильных электролитов (α≈1): α=(i-1)/(n-1) NaCl ↔ Na+ + Cl- 2 иона => n=2, i=2 при
- 49. Скачать презентацию

































 Аммиак
Аммиак Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Комплексные соединения. Определения
Комплексные соединения. Определения Коррозия металлов
Коррозия металлов Классификация органических соединений
Классификация органических соединений Производство извести
Производство извести Добування кисню
Добування кисню Водород
Водород Строение атома (лекция 3)
Строение атома (лекция 3) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Алканы
Алканы Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Горение топлива
Горение топлива Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Алкины. Ацетилены
Алкины. Ацетилены Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Химические реакции. Урок-обобщение
Химические реакции. Урок-обобщение Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Исследование снежного покрова
Исследование снежного покрова Алюминий и его соединения
Алюминий и его соединения Теоретические основы получения полимеров
Теоретические основы получения полимеров