Содержание
- 2. Из списка выберите кислоты Na2SO4, LiOH, HNO2 , Na2O, H3PO4, SO3, Н2СО3 , Са(ОН)2, ВаО, H2SiO3
- 3. HNO2, H3PO4, Н2СО3 , H2SiO3 Вспомним! Кто такие электролиты?
- 4. HnAcd = nH+ + Acdn- Вспомним! Общее уравнение электролитической диссоциации? Где: Acd – кислотный остаток Кислоты
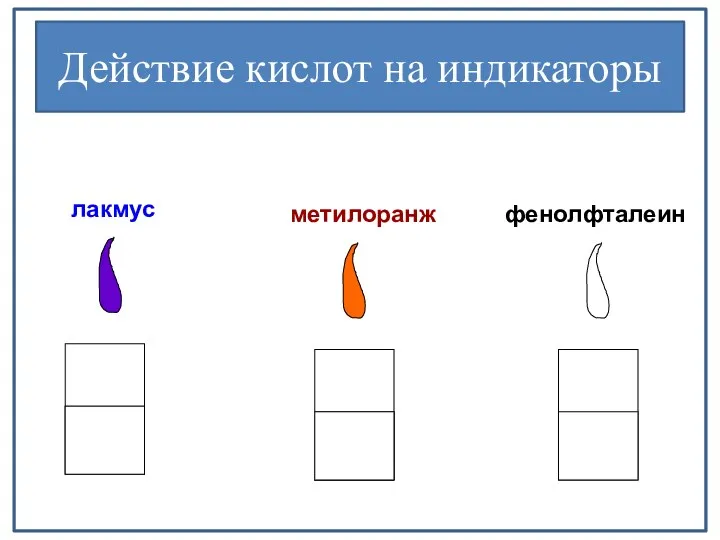
- 5. Общие химические свойства кислот 1. Обладают кислым вкусом 2. Изменяют окраску индикаторов
- 6. лакмус метилоранж фенолфталеин Действие кислот на индикаторы
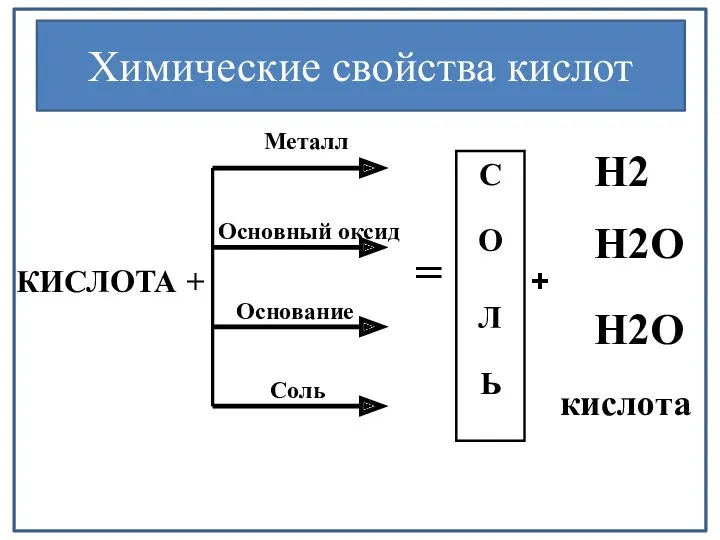
- 7. Химические свойства кислот КИСЛОТА + С О Л Ь Металл Основный оксид Основание Соль + Н2
- 8. 3. Взаимодействие с основаниями с образованием соли и воды
- 9. 2NaOH + H2SO4 = Na2SO4 + 2H2O Запись уравнения реакций с помощью формул веществ называют молекулярным
- 10. Однако, в растворе вещества диссоциируют на ионы и взаимодействия происходят между ионами Перепишем молекулярное уравнение следующим
- 11. 2Na+ + 2OH- 2NaOH + H2SO4 = Na2SO4 + 2H2O + 2H+ +SO4 2- = 2Na+
- 12. 2Na+ + 2OH- + 2H+ +SO4 2- = 2Na+ +2SO42- + 2H2O 2OH- + 2H+ =
- 13. 2OH- + 2H+ = 2H2O Катион водорода взаимодействует с гидроксид-анионами с образованием воды Это значит, что
- 14. Реакции обмена, протекающие в растворах с участием сильных электролитов, называют реакциями ионного обмена.
- 15. Взаимодействие кислот с нерастворимым основанием
- 16. М(OH)n↓ + сильная кислота (nH+ + Acdn-) → Мn+ + 2H2O Cu(OH)2 ↓ + 2HCl =
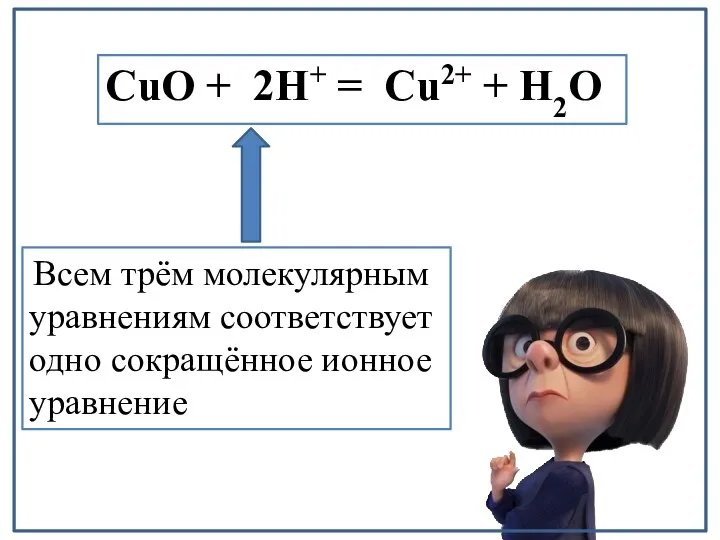
- 17. Cu(OH)2↓ + 2H+ = Cu2+ + 2H2O Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
- 18. 4. Взаимодействие с оксидами металлов с образованием соли и воды
- 19. MO + сильная кислота (nH+ + Acdn-) → Mn+ + 2H2O CuO + 2HCl = CuCl2
- 20. CuO + 2H+ = Cu2+ + H2O Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
- 21. 5. Взаимодействие с металлами с образованием соли и водорода Из сильных кислот по-особому взаимодействуют с металлами
- 22. Будучи сильными электролитами, эти вещества в растворе существуют не в виде молекул, а в виде ионов:
- 23. M + сильная кислота (nH+ + Acdn-) → Mn+ + H2↑ Ионное уравнение этого процесса: Zn
- 24. Запишите молекулярные уравнения реакций: между цинком и соляной кислотой между цинком и серной кислотой
- 25. Электрохимический ряд напряжений металлов Возможность протекания такой реакции определяется положением металла в ряду активности – электрохимическом
- 26. Условия реакции: 2) В результате этой реакции должна образоваться растворимая соль. Условия реакции: 3) С металлами
- 27. 6. Взаимодействие с солями с образованием другой соли и другой кислоты Реакция между растворами электролитов возможна
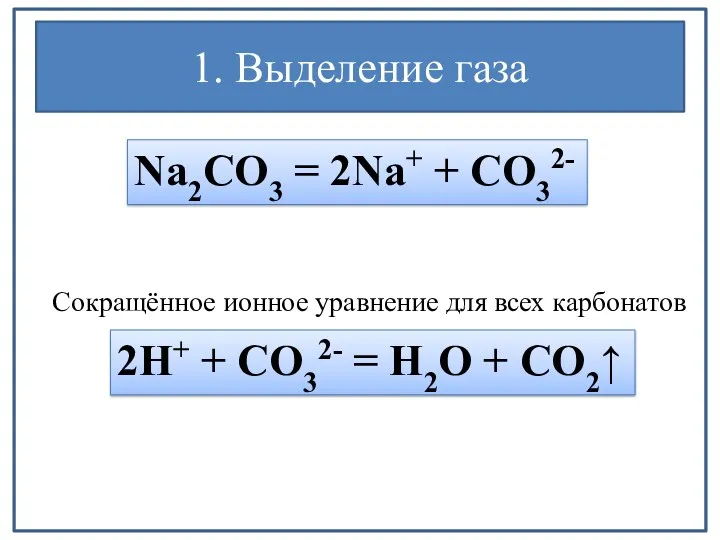
- 28. 1. Выделение газа Na2CO3 = 2Na+ + CO32- 2H+ + CO32- = H2O + CO2↑ Сокращённое
- 30. Скачать презентацию























 Реакции ионного обмена
Реакции ионного обмена Закономерности протекания химических реакций
Закономерности протекания химических реакций Магний (Mg)
Магний (Mg) Кислород
Кислород Стереоселективные синтезы
Стереоселективные синтезы Current Condition(Revision C)
Current Condition(Revision C) Как заменить всю химическую косметику натуральной
Как заменить всю химическую косметику натуральной Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Фосфор
Фосфор Энергетика химических процессов
Энергетика химических процессов Неорганические соединения галогенов
Неорганические соединения галогенов Коррозия металлов. Часть 2. Лекция №11
Коррозия металлов. Часть 2. Лекция №11 Ионная связь
Ионная связь Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества Кислород. Атом кислорода
Кислород. Атом кислорода Материаловедение. Придание металлам и сплавам заданных свойств
Материаловедение. Придание металлам и сплавам заданных свойств Полимеры
Полимеры Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Химическая промышленность России
Химическая промышленность России Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас)
Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас) Фенолдар. Анықтама
Фенолдар. Анықтама Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Производство азотной кислоты
Производство азотной кислоты