Содержание
- 2. Взаимодействие с газами Взаимодействие с водой Взаимодействие с технологическими средами ЛИТИЙ НАТРИЙ, КАЛИЙ, Na-K, ЦЕЗИЙ СВИНЕЦ,
- 3. ХИМИЧЕСКИЕ СВОЙСТВА ЛИТИЯ
- 4. ВЗАИМОДЕЙСТВИЕ ЛИТИЯ С КИСЛОРОДОМ, АЗОТОМ, УГЛЕРОДОМ, ВОДОЙ И ВОДЯНЫМ ПАРОМ
- 5. Свойства лития Литий взаимодействует с атмосферными газами. Это процесс зависит состава газовой среды, влажности, температуры, наличия
- 6. Взаимодействие лития с O2, N2, CO2 идет с выделением избыточного тепла по следующим реакциям (при 500oC):
- 7. При нормальных условиях литий медленно взаимодействует с воздухом. Конечным продуктом взаимодействия является Li2CO3∙OH. Взаимодействие твердого лития
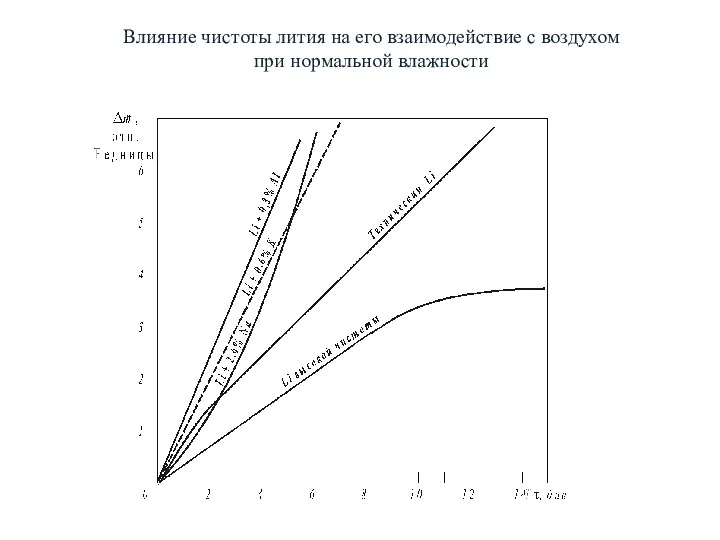
- 8. Влияние чистоты лития на его взаимодействие с воздухом при нормальной влажности
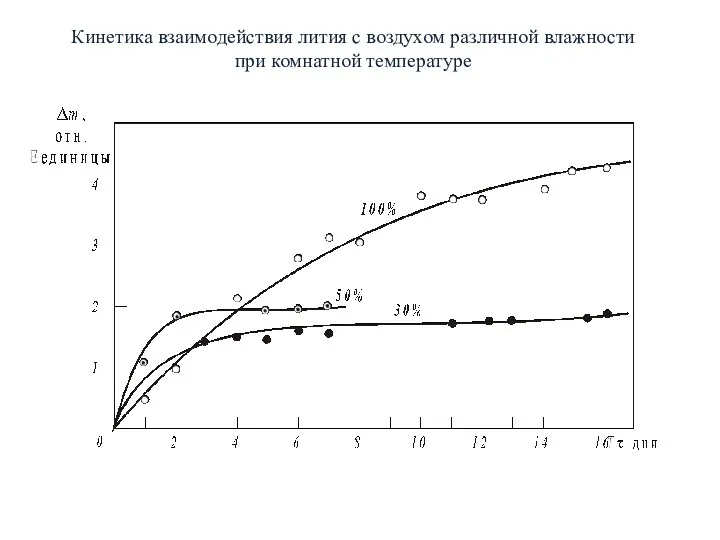
- 9. Кинетика взаимодействия лития с воздухом различной влажности при комнатной температуре
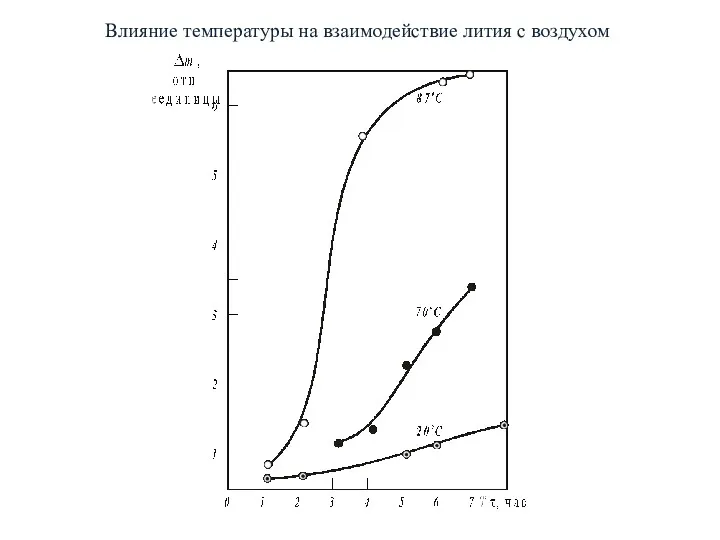
- 10. Влияние температуры на взаимодействие лития с воздухом
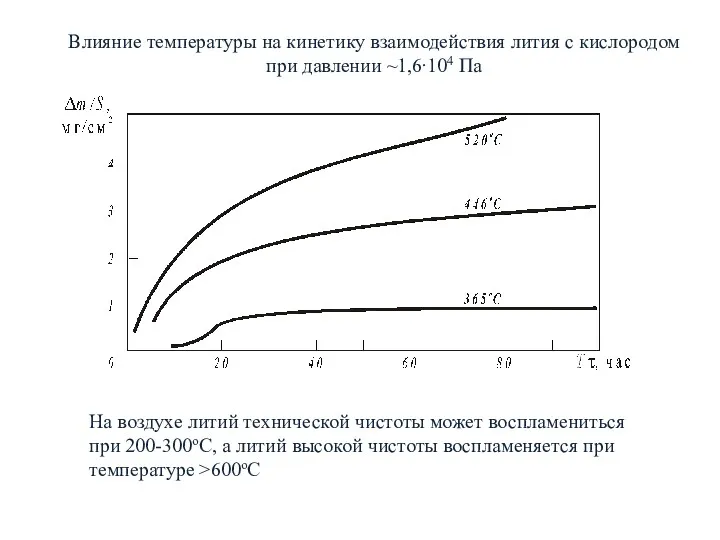
- 11. Влияние температуры на кинетику взаимодействия лития с кислородом при давлении ~1,6∙104 Па На воздухе литий технической
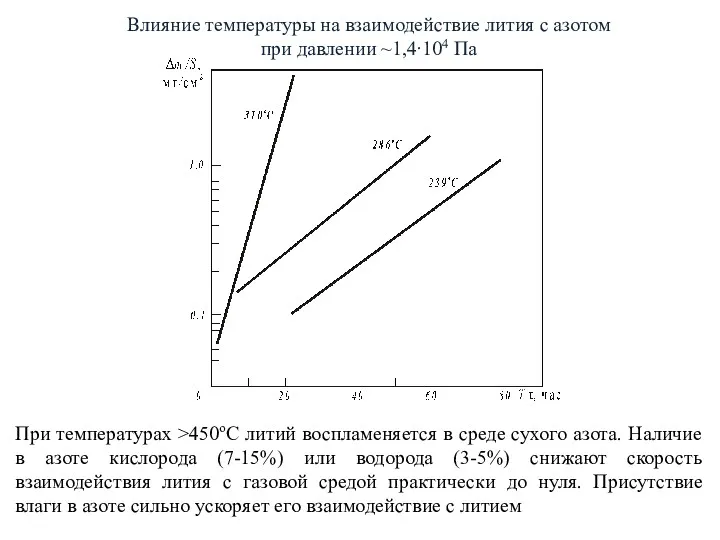
- 12. Влияние температуры на взаимодействие лития с азотом при давлении ~1,4∙104 Па При температурах >450оС литий воспламеняется
- 13. При взаимодействии открытой поверхности жидкого металла с воздухом при нормальной влажности происходит его горение, температура которого
- 14. Li марки ЛЭ-1 (>99,5% Li; основные примеси: Na, Ca, O, N ...) Время экспозици на воздухе
- 15. 10 с после раз-реза 45 с 1 час 3 часа 17 дней 8 дней 3 дня
- 16. Конденсат Li на фольге из нержавеющей стали Чистота Li >99.99% обеспечивалась низкой температурой испарения - ~600oC)
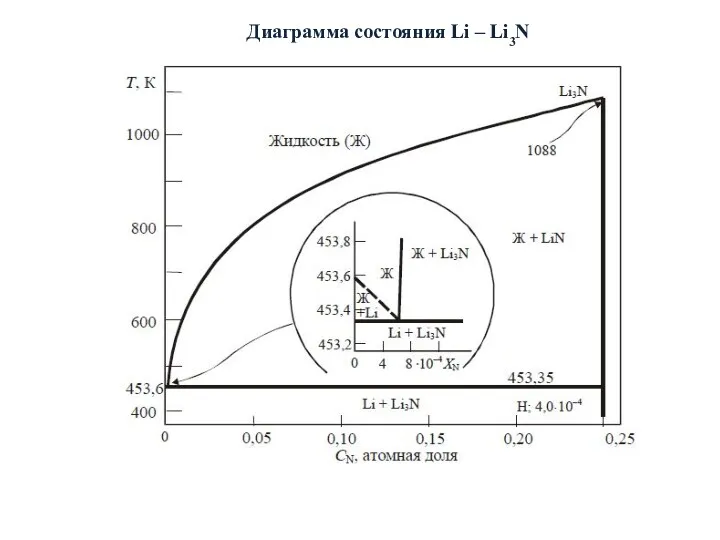
- 17. Диаграмма состояния Li – Li3N
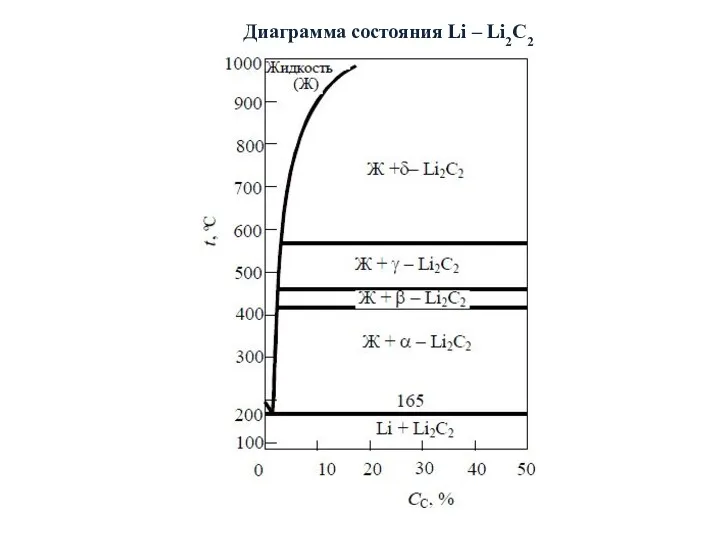
- 18. Диаграмма состояния Li – Li2C2
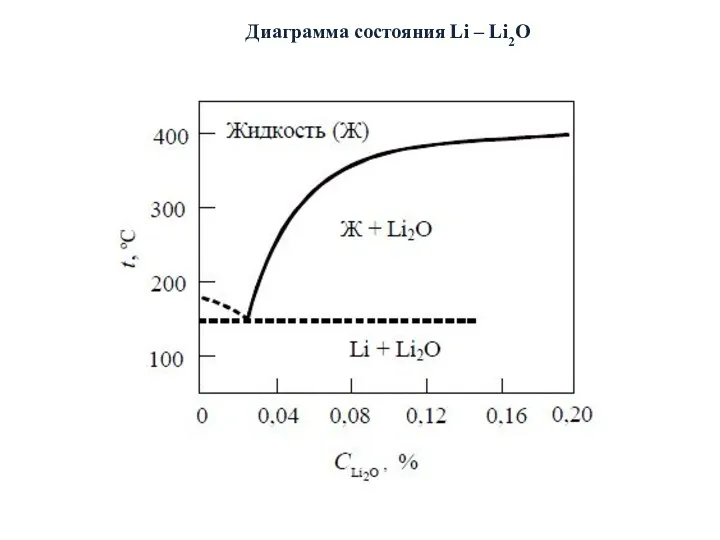
- 19. Диаграмма состояния Li – Li2O
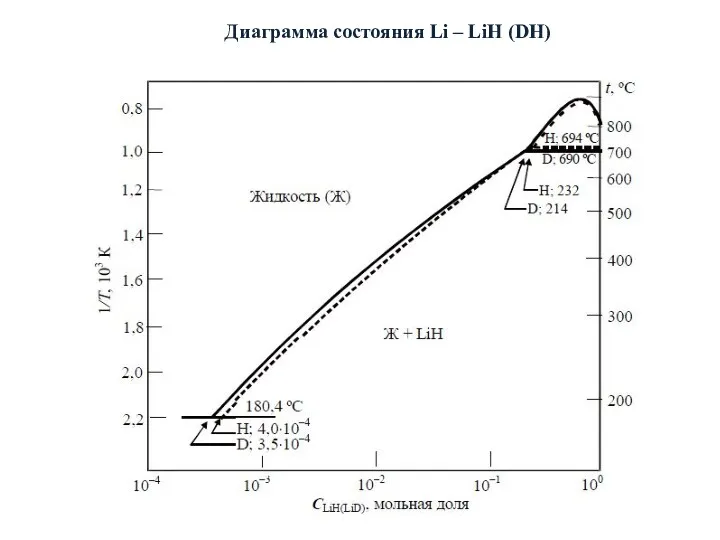
- 20. Диаграмма состояния Li – LiH (DH)
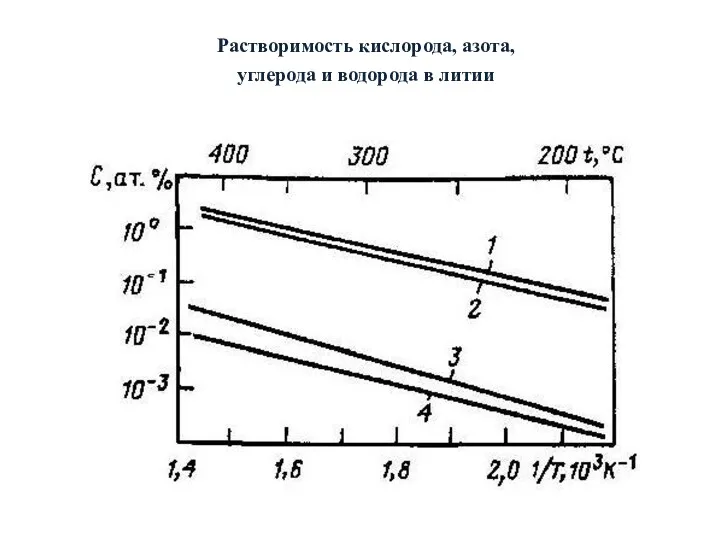
- 21. Зависимость растворимости неметаллических примесей, в литии и других жидких металлах в практически интересующем интервале температур описывается
- 22. Растворимость кислорода, азота, углерода и водорода в литии
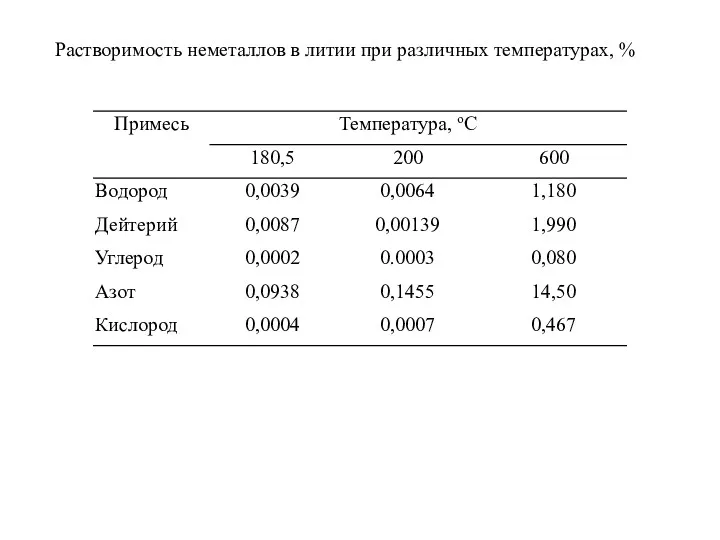
- 23. Растворимость неметаллов в литии при различных температурах, %
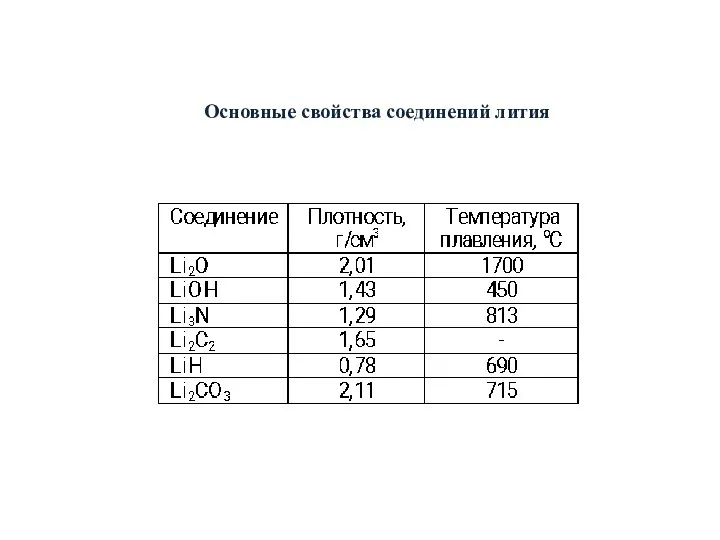
- 24. Основные свойства соединений лития
- 25. ХИМИЧЕСКИЕ СВОЙСТВА НАТРИЯ, КАЛИЯ, ЦЕЗИЯ
- 26. Свойства натрия При непосредственном взаимодействии натрия с кислородом в зависимости от условий образуется оксид Na2O или
- 27. Взаимодействие натрия с водой, спиртом Реагируя с водой Na образует гидрооксид NaOH и H2; реакция может
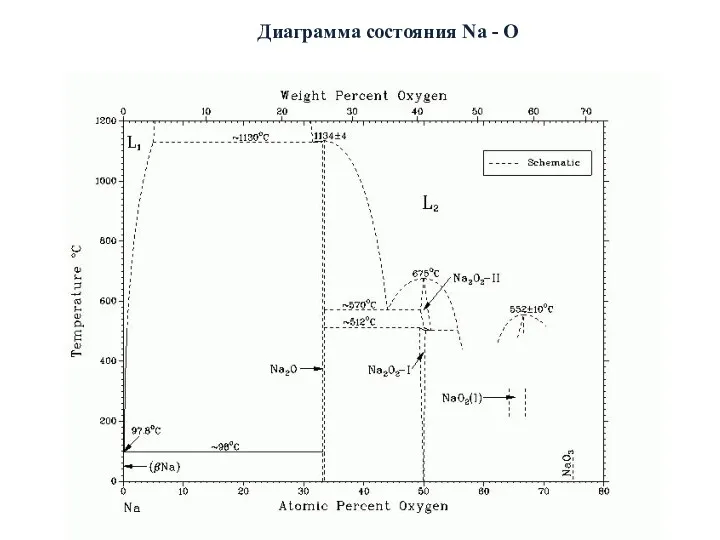
- 28. Диаграмма состояния Na - O
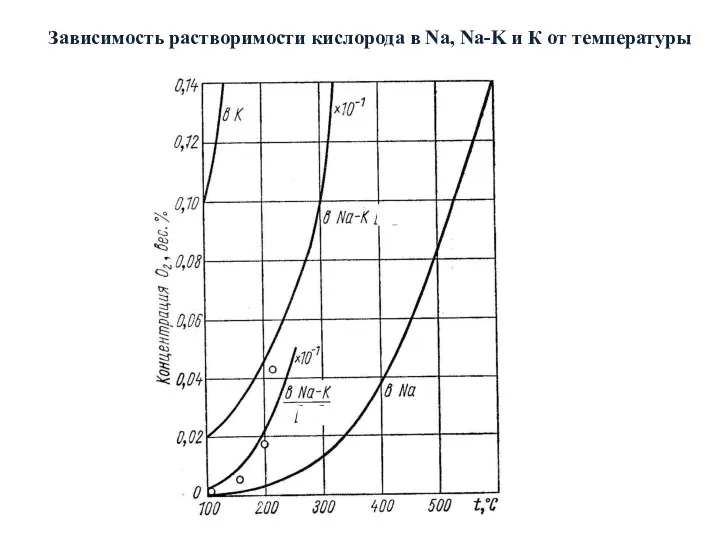
- 29. Зависимость растворимости кислорода в Na, Na-K и К от температуры
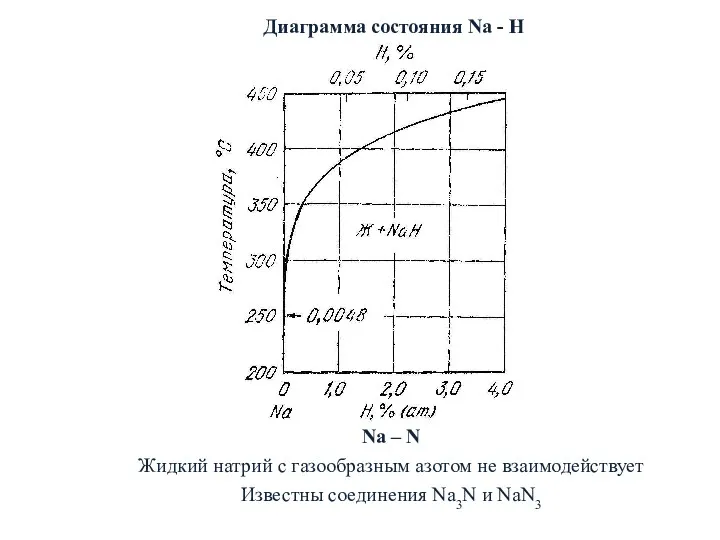
- 30. Диаграмма состояния Na - H Na – N Жидкий натрий с газообразным азотом не взаимодействует Известны
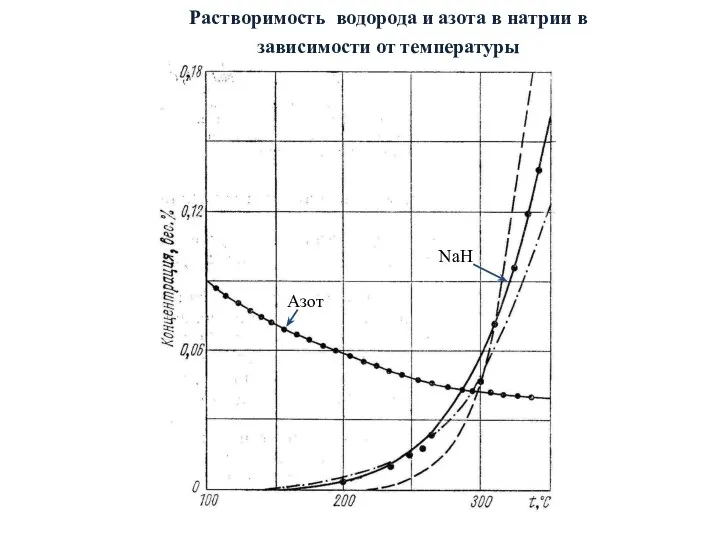
- 31. Растворимость водорода и азота в натрии в зависимости от температуры Азот NaH
- 32. Свойства калия Валентный электрон атома калия более удален от его ядра, чем валентные электроны лития и
- 33. Свойства цезия Цезий обладает очень высокой реакционной способностью. На воздухе мгновенно воспламеняется с образованием пероксида Cs2O2
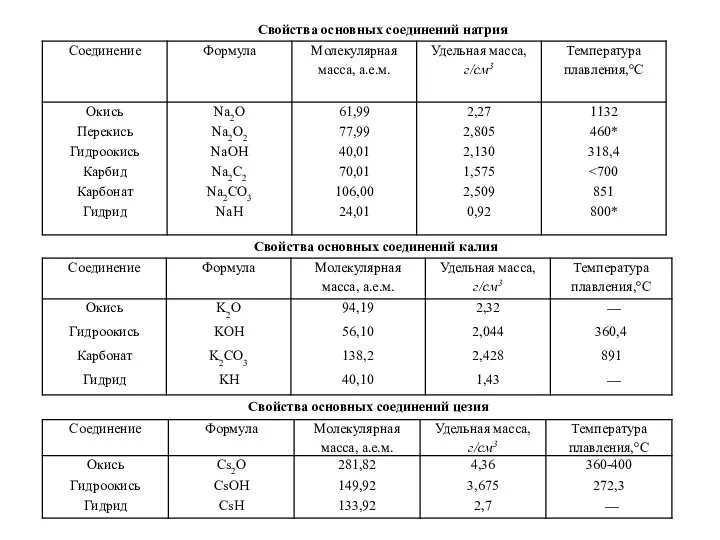
- 34. Свойства основных соединений натрия Свойства основных соединений калия Свойства основных соединений цезия
- 35. ХИМИЧЕСКИЕ СВОЙСТВА СВИНЦА и Li17Pb83
- 36. Свинец сравнительно мало активен химически. С кислородом свинец образует оксиды Рb2О, РbО, РbО2, Рb3О4 и Рb2О3.
- 37. Свинец хорошо растворим в разбавленной азотной кислоте, а в серной и соляных кислотах растворяется лишь при
- 38. В свинце неметаллические примеси растворяются по сравнению с литием незначительно. Растворимость кислорода в свинце, весьма низка
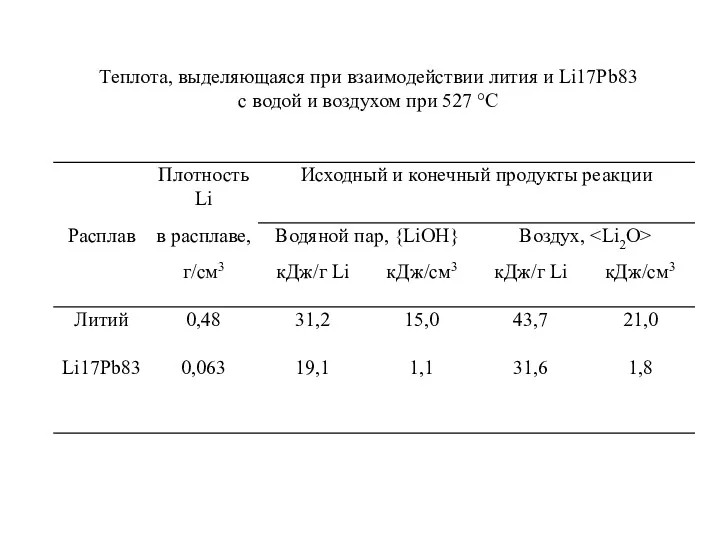
- 39. Теплота, выделяющаяся при взаимодействии лития и Li17Pb83 с водой и воздухом при 527 °С
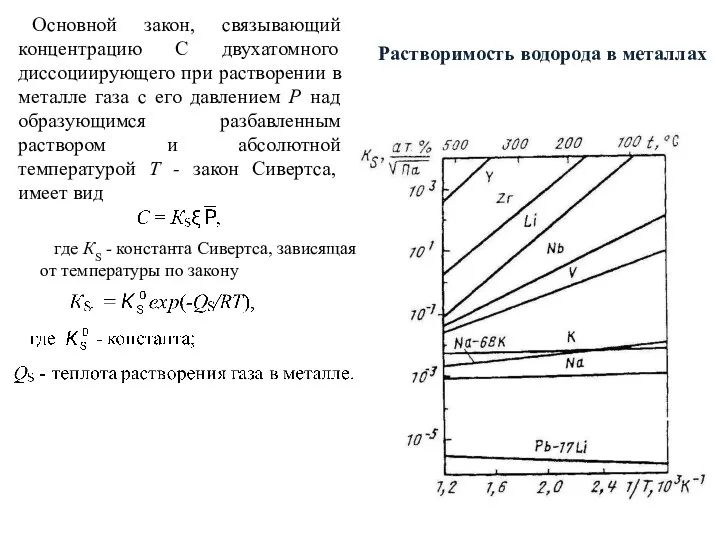
- 40. Растворимость водорода в металлах Основной закон, связывающий концентрацию С двухатомного диссоциирующего при растворении в металле газа
- 41. ХИМИЧЕСКИЕ СВОЙСВА ГАЛЛИЯ
- 42. Химические свойства галлия близки к свойствам алюминия. Оксидная плёнка Ga2O3 (Тпл= 1795°C), образующаяся на поверхности металла
- 43. Галлий реагирует с галогенами: реакция с хлором и бромом идёт при комнатной температуре, с фтором —
- 44. ВЗАИМОДЕЙСТВИЕ ЖИДКИХ МЕТАЛЛОВ С ТЕХНОЛОГИЧЕСКИМИ СРЕДАМИ
- 45. ЛИТИЙ Литий активно взаимодействует с разбавленными неорганическими кислотами (HNO3, H2SO4, HF, HCl) С концентрированными HNO3, HCl
- 46. НАТРИЙ, КАЛИЙ, Na-K С разбавленными растворами неорганических кислот Na, K реагируют со взрывом. С органическими кислотами
- 48. Скачать презентацию


























 B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Геохимия гидросферы
Геохимия гидросферы Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Чистые вещества и смеси
Чистые вещества и смеси Амины
Амины Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1
Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1 Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Organic compounds: nomenclature
Organic compounds: nomenclature Изотопный обмен
Изотопный обмен Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Классификация органических соединений
Классификация органических соединений Типы химических реакций
Типы химических реакций Уральские горы. Самоцветы
Уральские горы. Самоцветы Углерод
Углерод Ионная химическая связь
Ионная химическая связь Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Композиты и композиционные материалы
Композиты и композиционные материалы Щелочные металлы
Щелочные металлы Механизмы реакций органических соединений
Механизмы реакций органических соединений Пластмасса
Пластмасса Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Алканы. Углеводороды. Предельные (насыщенные, алканы)
Алканы. Углеводороды. Предельные (насыщенные, алканы) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Азот и его соединения
Азот и его соединения Водородная связь
Водородная связь Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Полимеры. Каучук
Полимеры. Каучук