Слайд 2

Обобщение и систематизация знаний по теме:
«Химические реакции в растворах электролитов»
Слайд 3

Цель урока:
обеспечить восприятие и осмысление основных понятий данной темы, закрепить
навыки составления уравнений электролитической диссоциации, молекулярных и ионных уравнений реакций; совершенствовать навыки, планировать и проводить эксперимент.
Слайд 4

I cтанция
«Подготовка к путешествию»
Слайд 5

Положительно заряженные частицы
Слайд 6
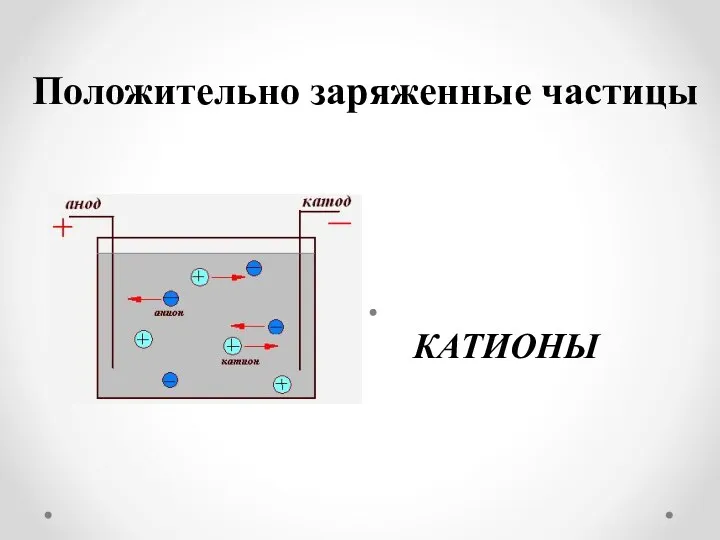
Положительно заряженные частицы
КАТИОНЫ
Слайд 7

Отрицательно заряженные частицы
Слайд 8
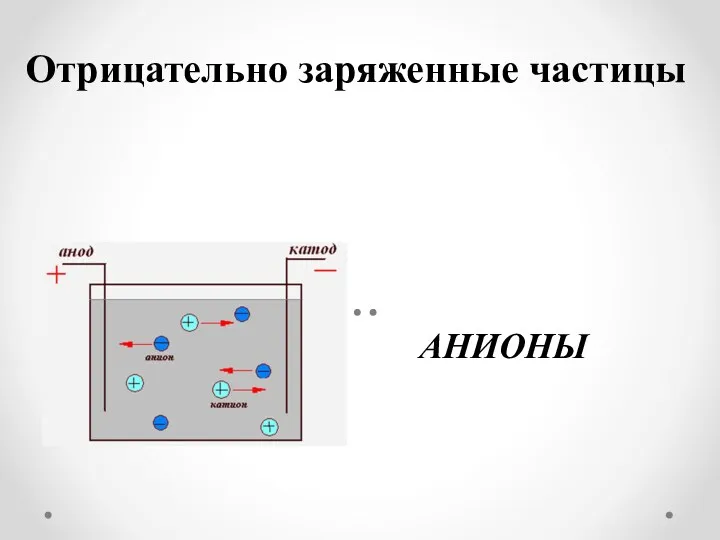
Отрицательно заряженные частицы
АНИОНЫ
Слайд 9

Вещества, водные растворы которых не проводят электрический ток
Слайд 10

Вещества, водные растворы которых не проводят электрический ток
НЕЭЛЕКТРОЛИТЫ
Слайд 11

Процесс распада электролита
на ионы называется
Слайд 12
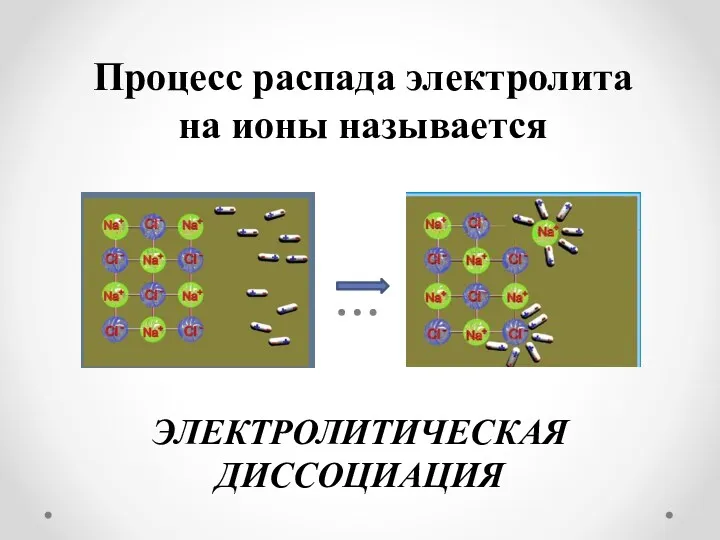
Процесс распада электролита
на ионы называется
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Слайд 13

Электролиты, при диссоциации которых в качестве анионов образуются гидроксид - анион
Слайд 14

Электролиты, при диссоциации которых в качестве анионов образуются гидроксид - анион
ОСНОВАНИЯ
Слайд 15

Вещества, водные растворы которых проводят электрический ток
Слайд 16

Вещества, водные растворы которых проводят электрический ток
ЭЛЕКТРОЛИТЫ
Слайд 17

Электролиты, при диссоциации которых в качестве катионов образуются ионы водорода
Слайд 18

Электролиты, при диссоциации которых в качестве катионов образуются ионы водорода
КИСЛОТЫ
Слайд 19

Электролиты, водные растворы которых полностью
диссоциируют на ионы
Слайд 20

Электролиты, водные растворы которых полностью
диссоциируют на ионы
СИЛЬНЫЕ
ЭЛЕКТРОЛИТЫ
Слайд 21

Электролиты, водные растворы которых лишь частично диссоциируют на ионы
Слайд 22

Электролиты, водные растворы которых лишь частично диссоциируют на ионы
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Слайд 23

Основоположник теории электролитической диссоциации
Слайд 24

Основоположник теории электролитической диссоциации
Сванте Аррениус
(открыта в 1887)
Слайд 25

Назовите основные положения теории
электролитической диссоциации
Слайд 26

Назовите основные положения теории
электролитической диссоциации
Все вещества по способности проводить электрический
ток в водных растворах или в расплавах делят на
электролиты и неэлектролиты.
В растворе электролиты диссоциируют из-за гидратации
В результате диссоциации образуются гидратированные
ионы.
Сильные и слабые электролиты по-разному
диссоциируют на ионы.
Слайд 27

II станция город «Электролитов»
Слайд 28

Необходимо выписать сильные электролиты (вариант- 1).
Составить уравнения их диссоциации. Определить
характер химической связи. Процесс диссоциации: обратимый или необратимый (диссоциация и ассоциация).
ВАРИАНТ – 1
K2CO3, HNO3, H2O, FeCl3, Cu(OH)2, NH3*H2O
Необходимо выписать слабые электролиты (вариант-2).
Составить уравнения их диссоциации. Определить характер химической связи. Процесс диссоциации: обратимый или необратимый (диссоциация и ассоциация).
ВАРИАНТ - 2
H2O, H2SO3, NaOH, NH3*H2O, K2S, Al(NO3)3
Слайд 29

III станция город
«Классы неорганических соединений»
Слайд 30

Правило технике безопасности:
1. В кабинете химии веди себя спокойно.
2. Вещества нельзя пробовать на
вкус.
3. Вещества необходимо брать в небольших количествах.
4. С кислотами и щелочами работать можно, но крайне осторожно!
5. Получив задание, работу выполняй. С соседом не болтай. А закончив работу, всё на место убери и порядок наведи.
Слайд 31

Условия протекания
реакций ионного обмена до конца
образование
осадка
выделение
газа
образование
малодиссоциированного
вещества (вода)
Слайд 32

Реакции ионного обмена – это реакции обмена,
которые протекают между ионами.
Для реакций ионного обмена составляют полные и сокращенные ионные уравнения.
При этом на ионы никогда не раскладывают :
нерастворимые вещества (таблица растворимости);
оксиды;
воду;
газы
Слайд 33

После того, как человек провёл первую химическую реакцию – разжёг костёр,
ему пришлось задуматься о том, как управлять течением химических реакций. Сегодня человек умеет управлять реакцией, может замедлять нежелательные превращения веществ или ускорять реакции для получения большего количества нужного продукта. Скорость химической реакции определяется как изменение концентрации реагирующих веществ в единицу времени. Известно, что скорость химических реакций зависит от температуры, концентрации реагирующих веществ, наличие катализатора или ингибитора (вещества, замедляющего реакцию).
На уроке химии учащиеся проводили эксперименты с целью определить факторы, которые влияют на скорость различных реакции. Они провели несколько опытов.
Опыт 1. Ученики взяли 10г соляной кислоты с массовой долей вещества 20% и опустили в этот раствор гранулы цинка. Наблюдали выделение газа?
Опыт 2. К соляной кислоте из первого опыта добавили 30мл воды. Затем отобрали 10 г получившегося раствора и опустили гранулы цинка.
Наблюдали выделение газа?
В каком из опытов ученики наблюдали более интенсивное выделение газа?
Действие какого фактора, влияющего на скорость реакции, наблюдали учащиеся?
Слайд 34

Задание второе
В 5 пронумерованных пробирках находятся растворы:
Хлорид калия
Карбонат натрия
Хлорид бария
Сульфат магния
Нитрат
серебра
Как не используя других реактивов определить в какой пробирке находится каждое из веществ.
Ответ оформите в виде таблицы и составьте уравнение (уравнение запишите дома – в молекулярном, полном и сокращённом ионном виде).
Слайд 35

Слайд 36

Слайд 37

Задание третье Выпечка хлеба
С древности для приготовления теста для хлеба
хлебопёк смешивает муку, воду, соль и дрожжи. После этого тесто длительно месит и помещают на несколько часов в тёплое место, чтобы начался процесс брожения. Ферменты, вырабатываемые дрожжами, являются катализаторами реакций брожения (наибольшая скорость реакции достигается при t=35оС, а при t=40оС реакция прекращается, так как дрожжевые грибки гибнут. На разрезе качественного хлеба, приготовленного из кислого теста, видно множество мелких отверстий. Это результат химических реакций, протекающих с выделением углекислого газа, воды (пара) и других газообразных продуктов. В реакциях участвуют молекулы крахмала и белков, некоторые разлагаются на более мелкие молекулы при t=70-80оС. В процессах созревания и выпечки теста образуются глюкоза, спирт, кислоты, газы и другие органические и неорганические вещества, создающие структуру и особый вкус, аромат хлеба.
Слайд 38

Вопрос
В процессе брожения при t=25-35оС тесто подходит-поднимается, увеличивается в объёме в
2-3 раза.
Почему тесто поднимается? Отметьте один верный ответ.
Слайд 39

IV станция город «Химическая эстафета»
Слайд 40

Уравнения реакций рассмотреть с точки зрения ТЭД.
S →SO3→H2SO4→BaSO4→H2SO4
Слайд 41

Рефлексия:
1. Я узнал (а) много нового.
2. Мне это пригодится в жизни.
3. На уроке было
над чем подумать.
4. На все возникшие у меня в ходе урока вопросы я получил (а) ответы.
5. На уроке я поработал (а) добросовестно и цели урока достиг (ла).
Слайд 42

Д/з: параграф 4-8, + доделать второе задание функциональной грамотности. подготовиться к
практической работе № 1.
Задание повышенного уровня.
Предложите ионные реакции для очистки сточных вод автотранспортного предприятия от катионов Pb2+ и Cu2+, оказывающих токсическое действие на живые организмы.









































 Аміни
Аміни Электронное строение атома
Электронное строение атома Оксиды. Физические и химические свойства
Оксиды. Физические и химические свойства Е-числа в школьном буфете
Е-числа в школьном буфете Амины-1
Амины-1 Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Художественная обработка металла
Художественная обработка металла Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс) Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс
Техника безопасности в химической лаборатории; основные виды лабораторной посуды и оборудования, 8 класс Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Химическое равновесие
Химическое равновесие Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Химико-токсикологическое исследование кокаина
Химико-токсикологическое исследование кокаина Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Круговорот углерода в природе
Круговорот углерода в природе Кобальт. Химический элемент
Кобальт. Химический элемент Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Амин қышқылдар
Амин қышқылдар Свойства спирта и воды
Свойства спирта и воды Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Типы химических реакций
Типы химических реакций Нефть и способы ее переработки (10 класс)
Нефть и способы ее переработки (10 класс) Элементарные частицы вещества
Элементарные частицы вещества Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Алюминий и его соединения
Алюминий и его соединения