Содержание
- 2. План работы по теме «Оксиды» Определение Классификация Номенклатура Физические свойства Химические свойства Получение Применение
- 3. Подумай, закончи строфу! С кислородом ходит парой, То металл, то неметалл он, Дружбу связями скрепит Всем
- 4. Слайд – «ключ» Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых
- 5. Относятся к оксидам: MgO, H2O, Na2O, CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3
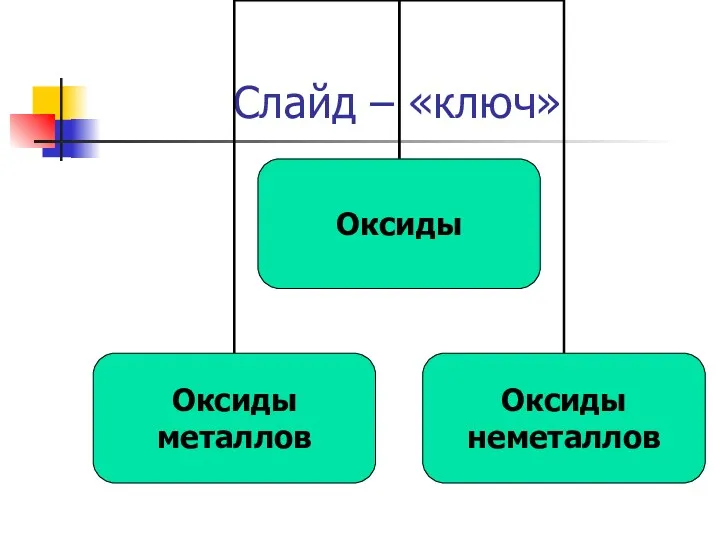
- 6. Слайд – «ключ»
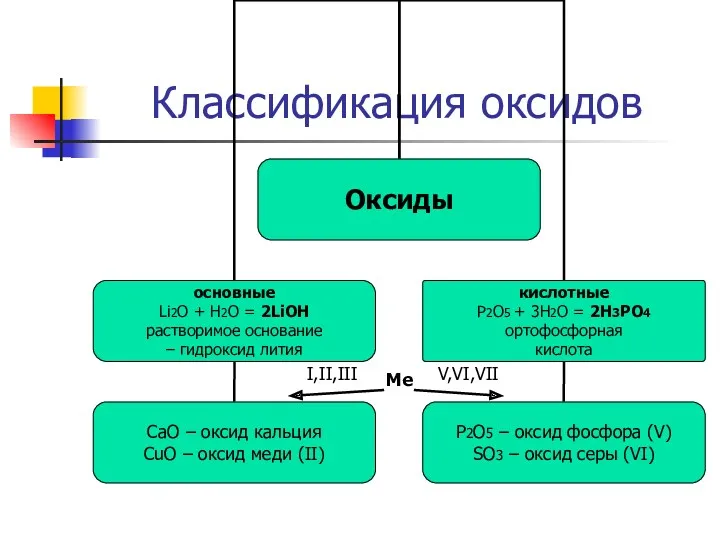
- 7. Классификация оксидов Me I,II,III V,VI,VII
- 8. Запомни! Неметаллы, знай, мой друг, Строго все себя ведут: Коль в оксиды он подался – Так
- 9. Номенклатура оксидов MgO – оксид магния, H2O – оксид водорода, Na2O – оксид натрия.
- 10. Дайте названия оксидам CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3
- 11. Примеры названия оксидов, в которые входят элементы с переменной валентностью II CO – оксид углерода (II)
- 12. Физические свойства оксидов Широка натура у оксидов, Камнем вниз, а то рекой течет, А захочет –
- 13. Слайд – «ключ» Широка натура у оксидов, Камнем вниз (CuO, CaO), а то рекой течет (H2O),
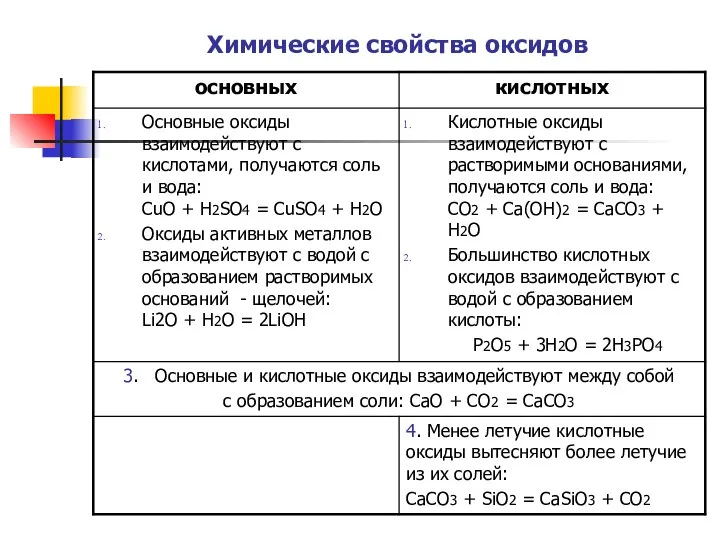
- 14. Химические свойства оксидов
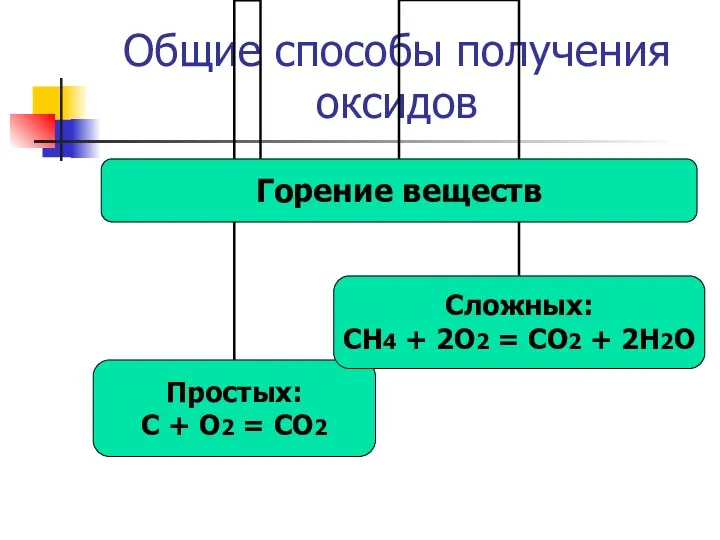
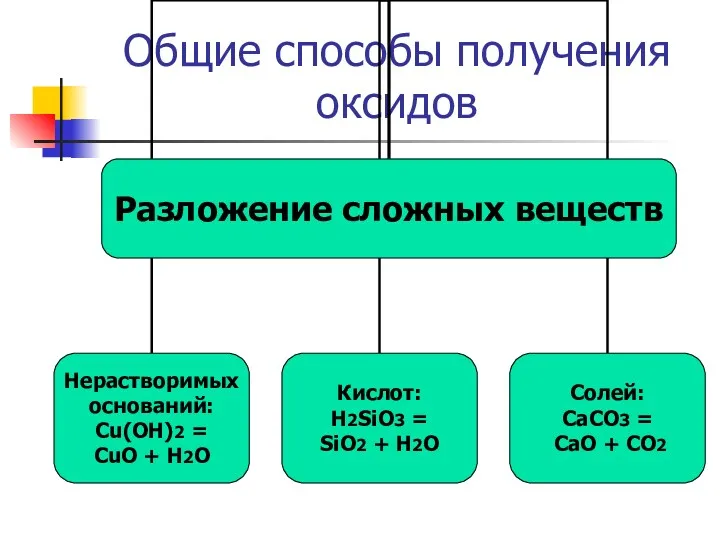
- 15. Общие способы получения оксидов
- 16. Общие способы получения оксидов
- 17. Основные области применения оксидов В промышленности: Fe2O3 и Fe3O4 – производство чугуна и стали, СaO и
- 19. Скачать презентацию











 Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Сероводород. Сульфиды
Сероводород. Сульфиды Растворы. Реакции ионного обмена. Гидролиз солей
Растворы. Реакции ионного обмена. Гидролиз солей Предельные одноатомные спирты
Предельные одноатомные спирты Пластмассы
Пластмассы Вирощення кристталів
Вирощення кристталів Химическая связь
Химическая связь Свойства минералов
Свойства минералов Метал конструкциялық материалдар
Метал конструкциялық материалдар Классы неорганических веществ
Классы неорганических веществ Теория строения органических соединений
Теория строения органических соединений Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Фенолы
Фенолы Стирка по научному
Стирка по научному Кислоты. Определение и классификация
Кислоты. Определение и классификация Магматические горные породы
Магматические горные породы Соединения железа
Соединения железа Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Эфирные масла
Эфирные масла Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Классы неорганических соединений
Классы неорганических соединений Предельные углеводороды и их производные
Предельные углеводороды и их производные Кислоты. Классификация кислот, их химические свойства
Кислоты. Классификация кислот, их химические свойства Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролитическая диссоциация
Электролитическая диссоциация