Содержание
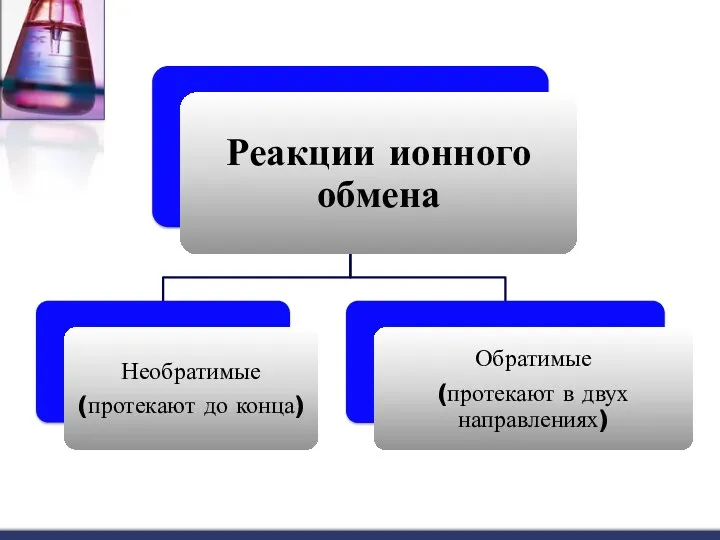
- 2. Реакции ионного обмена
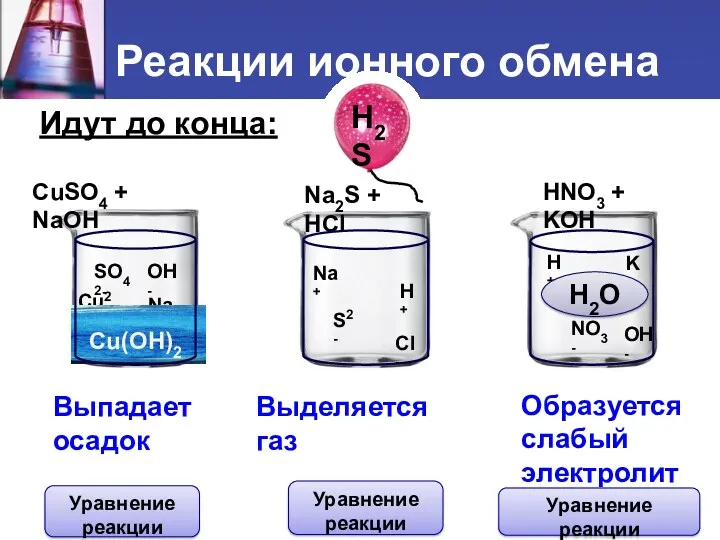
- 4. Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH-
- 5. Алгоритм составления уравнений Молекулярное уравнение CuSO4+2NaOH = Cu(OH)2 + Na2SO4 Полное ионное уравнение Сокращенное ионное уравнение
- 6. Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые основания
- 7. Составление уравнений Молекулярное уравнение Na2S+2HCl = H2S + 2NaCl Полное ионное уравнение Сокращенное ионное уравнение Na
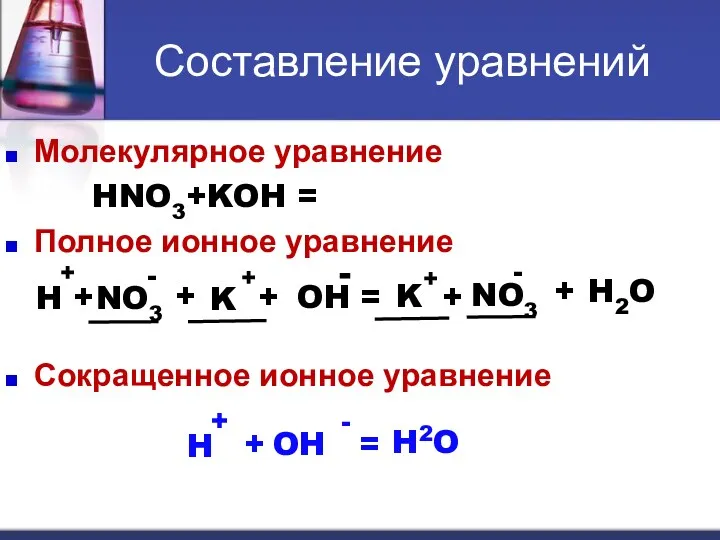
- 8. Составление уравнений Молекулярное уравнение HNO3+KOH = KNO3 + H2O Полное ионное уравнение Сокращенное ионное уравнение H
- 9. Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые и
- 10. Обратимые реакции Na2SO4 + KNO3 Na+ SO42- K+ NO3- 1.Нет осадка 2.Не выделяется газ 3.Не образуется
- 11. Составление уравнений Молекулярное уравнение Na2SO4+2KNO3 2NaNO3 + K2SO4 Полное ионное уравнение 2Na + + SO4 2-
- 12. Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием осадка: 1.SO42-и H+ ;
- 13. В каких случаях РИО идут до конца Молодец Молодец Молодец Ошибка Ошибка Молодец Na2CO3 + HNO3
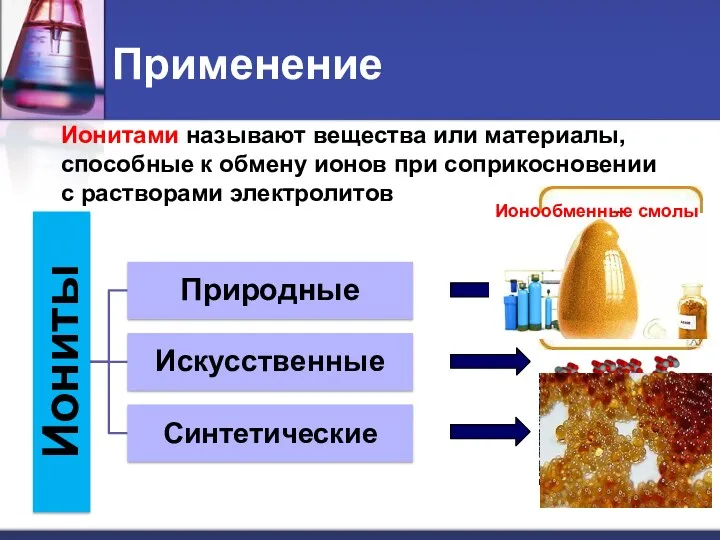
- 14. Применение Ионитами называют вещества или материалы, способные к обмену ионов при соприкосновении с растворами электролитов Цеолит
- 15. Применение ионитов Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие,
- 16. Применение ионитов В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина,
- 17. Применение ионитов Для извлечения металлов С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд.
- 19. Скачать презентацию












 Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Классификация и свойства оксидов
Классификация и свойства оксидов Цветные сплавы
Цветные сплавы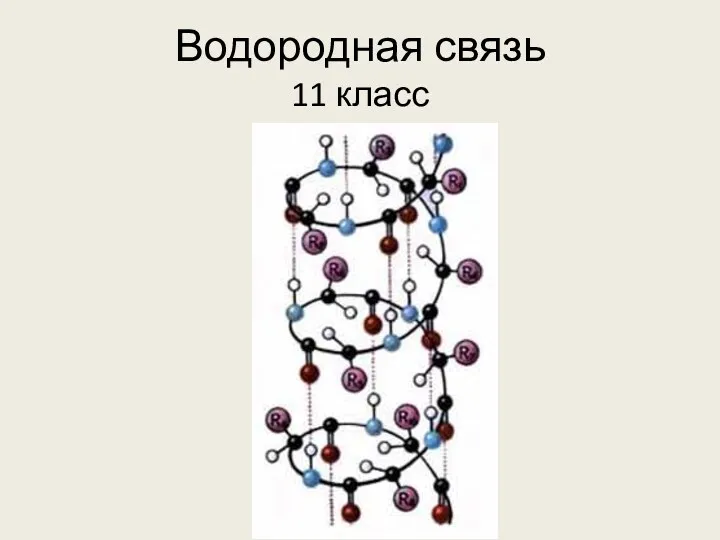 Водородная связь
Водородная связь Тяжелые металлы. Загрязнение токсичными металлами окружающей среды
Тяжелые металлы. Загрязнение токсичными металлами окружающей среды Виды вспомогательного оборудования химических производств
Виды вспомогательного оборудования химических производств Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Комплексономертиялық титрлеу. Дәріс № 6
Комплексономертиялық титрлеу. Дәріс № 6 Предельные углеводороды
Предельные углеводороды Физико-химические методы анализа. Лекция 1
Физико-химические методы анализа. Лекция 1 Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Строение атома и химическая связь
Строение атома и химическая связь Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Общая характеристика элементов IБгруппы. Медь. Серебро. Золото
Общая характеристика элементов IБгруппы. Медь. Серебро. Золото D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Alkynes
Alkynes Строение алканов. Физические и химические свойства алканов. Получение алканов
Строение алканов. Физические и химические свойства алканов. Получение алканов Карбоновые кислоты
Карбоновые кислоты Синтетические органические вещества
Синтетические органические вещества Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ
Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ