Содержание
- 2. Химическая кинетика изучает скорость и механизм химических процессов. v=моль/л∙с
- 3. Факторы, влияющие на скорость химической реакции Скорость химической реакции зависит: От природы реагирующих веществ: Н2 +
- 4. Факторы, влияющие на скорость химической реакции Скорость химической реакции зависит: 2. От состояния реагирующих веществ. 3.
- 5. Зависимость скорости химической реакции от температуры. Я. Вант–Гоффом сформулировано эмпирическое правило: с повышением температуры на 10
- 6. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. Где Vt2 – скорость химической реакции при температуре на 10
- 7. Закон действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в
- 8. В том случае, если химическая реакция проходит на разделе фаз (жидкость-газ, жидкость-твердое тело, твердое тело-газ), следует
- 9. Кинетическая классификация химических реакций согласно молекулярности и порядка реакции Молекулярность реакции определяется числом молекул, принимающих участие
- 10. Кинетическая классификация химических реакций Порядком реакции называется сумма степеней концентраций в кинетическом уравнении. Например: 1 v=kCCaCO3
- 11. Константа скорости. Константа скорости имеет свое выражение и размерность.
- 12. Период полупревращения В кинетике часто пользуются понятием периода полупревращения t1/2. Периодом полупревращения называется время, в течение
- 13. Методы определения порядка реакции: Метод подстановки. Графический метод. Дифференциальный метод.
- 14. Энергия активации. Значительное увеличение скорости реакции с увеличением температуры можно объяснить столкновением активных частиц с большим
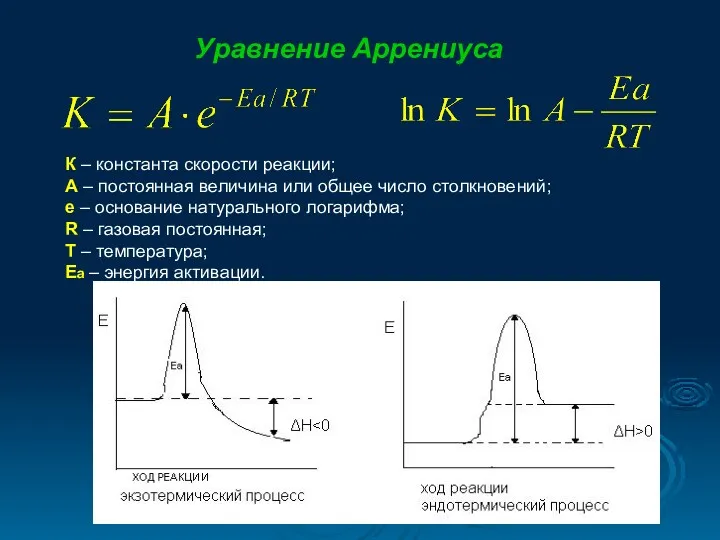
- 15. Уравнение Аррениуса К – константа скорости реакции; А – постоянная величина или общее число столкновений; е
- 16. Принцип необратимости химических реакций Необратимо идут реакции приводящие: к образованию газообразных веществ: Zn + 2H2SO4 (k)
- 17. Обратимые химические реакции. Константа равновесия. Реакции, которые идут в противоположных направлениях называются обратимыми. V1=K1CH2CI2; V2=K2CHI2 В
- 18. ПРИНЦИП ЛЕ ШАТЕЛЬЕ Смещение равновесия происходит по принципу Ле Шателье: Если на систему, находящуюся в устойчивом
- 19. ПРИНЦИП ЛЕ ШАТЕЛЬЕ 2СО + О2 = 2СО2; ∆Н Условие равновесия: ∆G =0; a ∆G=∆H-T∆S. G
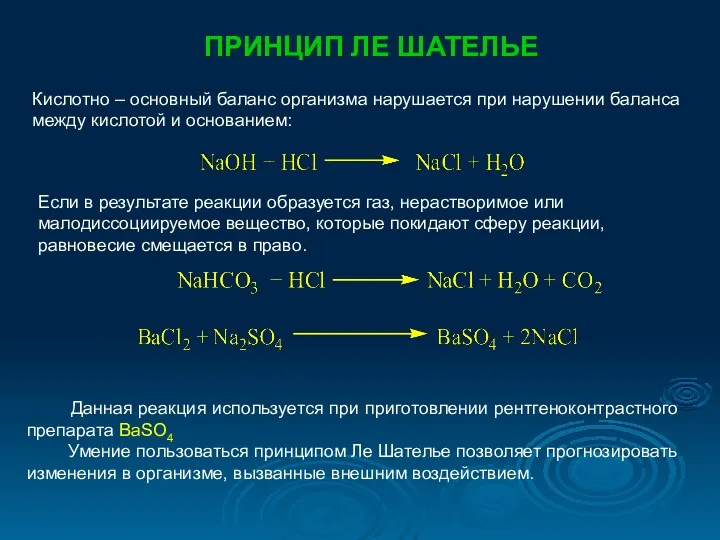
- 20. ПРИНЦИП ЛЕ ШАТЕЛЬЕ Кислотно – основный баланс организма нарушается при нарушении баланса между кислотой и основанием:
- 21. Каталитические реакции Катализ – процесс изменения скорости реакции при помощи катализаторов. Реакции, проходящие с участием катализаторов
- 22. Ферменты. Ферменты − белковые молекулы, способные ускорять протекание биохимических реакций. Кроме ферментов-белков существуют так называемые рибозимы
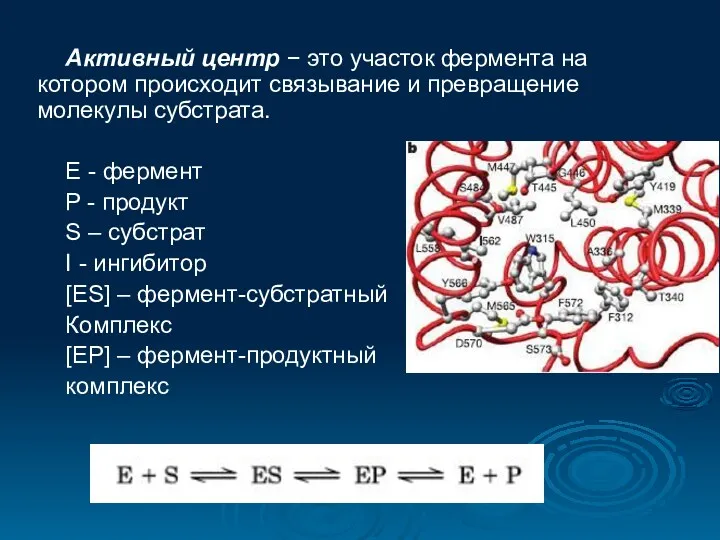
- 23. Активный центр − это участок фермента на котором происходит связывание и превращение молекулы субстрата. E -
- 24. Факторы, влияющие на активность фермента Концентрация субстрата. В 1913г. Михаэлис и Ментен проедложили уравнение = υmax[S]/Km+[S]
- 25. Специфичность ферментов: высокоспецифичные; низкоспецифичные; неспецифичные. Большинство ферментов высокоспецифичные, т.к. превращают 1 субстрат. Низкоспецифичные работают с группой
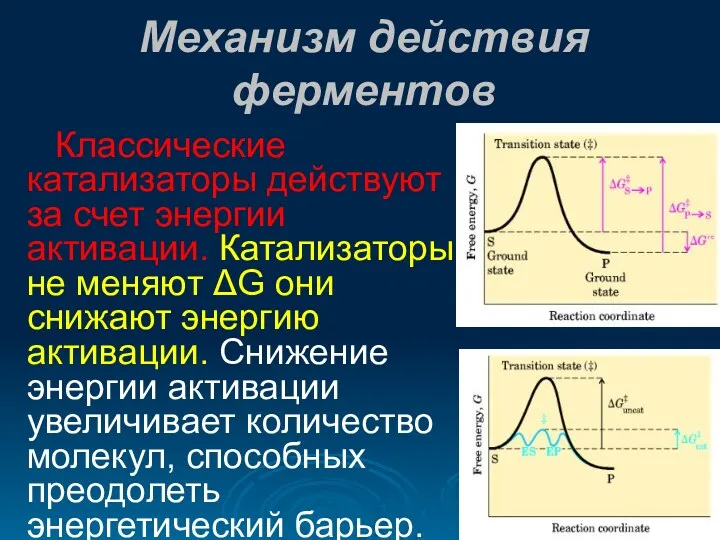
- 26. Механизм действия ферментов Классические катализаторы действуют за счет энергии активации. Катализаторы не меняют ΔG они снижают
- 27. Снижение энергии активации достигается за счет: 1. Ориентации субстратов. 2. Теория стерического взаимодействия. Фишер предположил, что
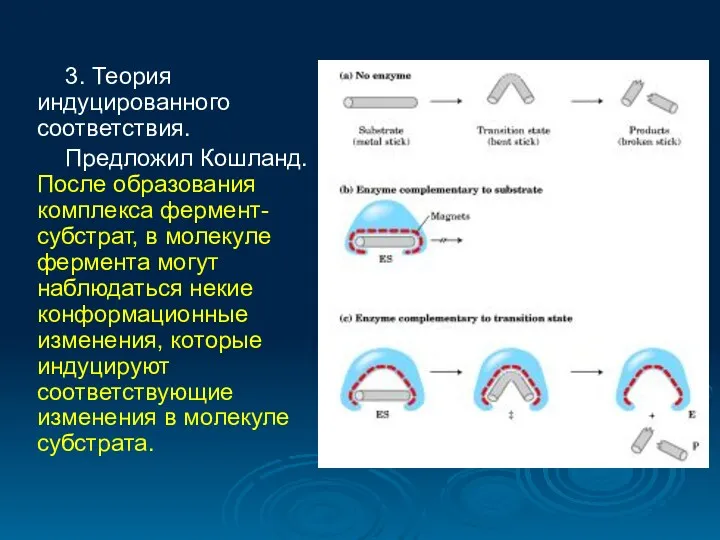
- 28. 3. Теория индуцированного соответствия. Предложил Кошланд. После образования комплекса фермент-субстрат, в молекуле фермента могут наблюдаться некие
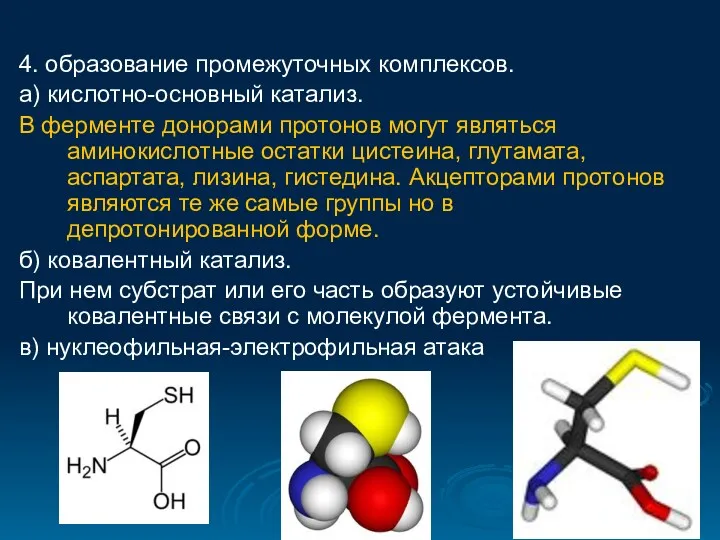
- 29. 4. образование промежуточных комплексов. а) кислотно-основный катализ. В ферменте донорами протонов могут являться аминокислотные остатки цистеина,
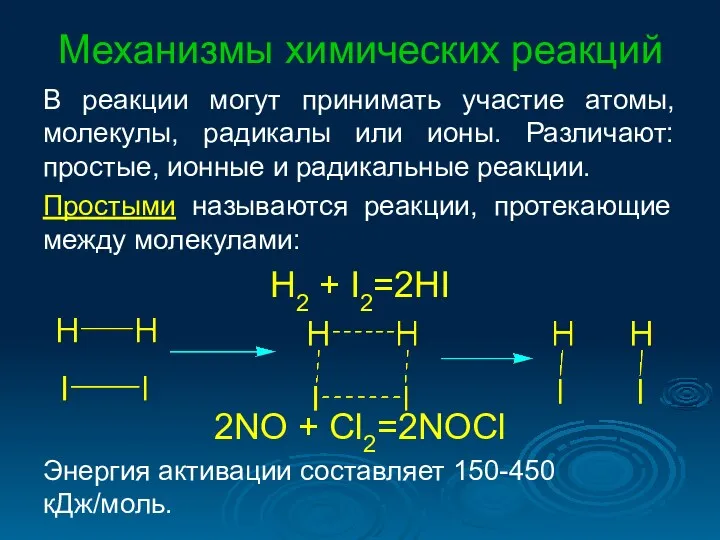
- 30. Механизмы химических реакций В реакции могут принимать участие атомы, молекулы, радикалы или ионы. Различают: простые, ионные
- 31. Механизмы химических реакций Цепные реакции. Радикальные реакции протекают по цепному механизму. Их особенность заключается в том,
- 33. Скачать презентацию























 Чистые вещества и смеси
Чистые вещества и смеси Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Щелочные металлы
Щелочные металлы The alkali metals
The alkali metals Предмет органической химии
Предмет органической химии Приготування розчинів
Приготування розчинів Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Энергоресурсы и их использование
Энергоресурсы и их использование Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Химические соединения в организме человека
Химические соединения в организме человека Углеводы. Моносахариды
Углеводы. Моносахариды Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Химические формулы
Химические формулы Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Добування кисню
Добування кисню Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Гидроксид аммония
Гидроксид аммония Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Кислород O2
Кислород O2 Химия и живопись
Химия и живопись Кислородные соединения азота
Кислородные соединения азота Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату