Содержание
- 6. Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Общая формула: CnH2n+1COOH
- 7. метановая кислота (муравьиная) этановая кислота (уксусная) пропановая кислота (пропионовая) RCOOH
- 8. М (Cn H2n+1 CОOH )=116 г/ моль 12n+2n+1+12+16+16+1=116 14n+46=116 14n=70 n=5 C5H11COOH гексановая кислота
- 9. МЕТАНОВАЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
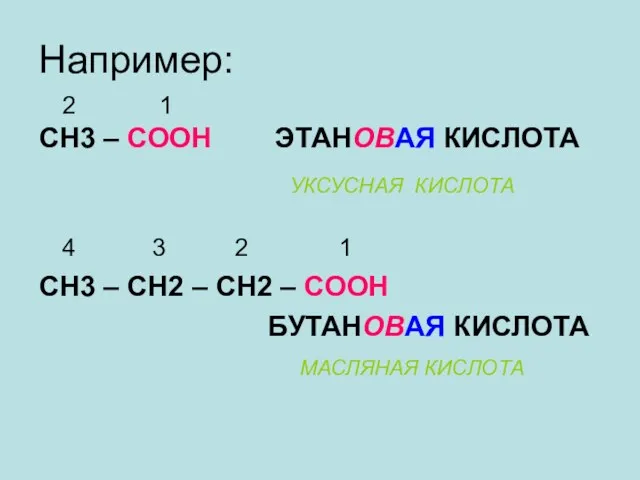
- 10. Например: 2 1 СН3 – СООН ЭТАНОВАЯ КИСЛОТА 4 3 2 1 СН3 – СН2 –
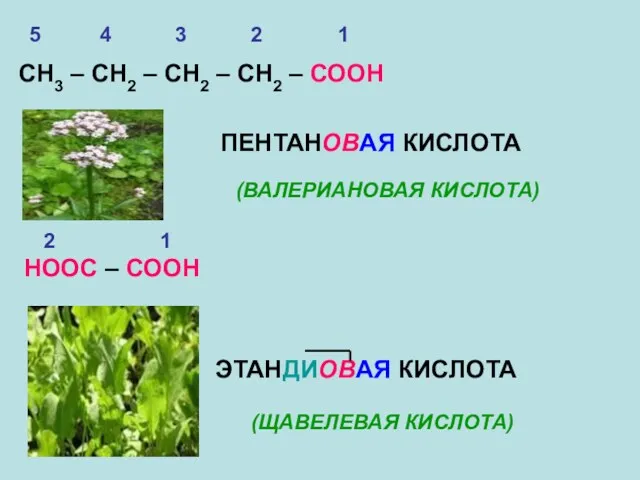
- 11. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) НООС – СООН
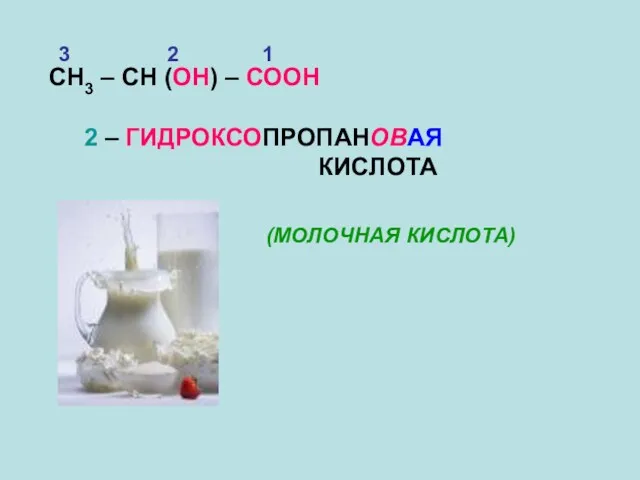
- 12. СН3 – СН (ОН) – СООН 1 2 3 2 – ГИДРОКСОПРОПАНОВАЯ КИСЛОТА (МОЛОЧНАЯ КИСЛОТА)
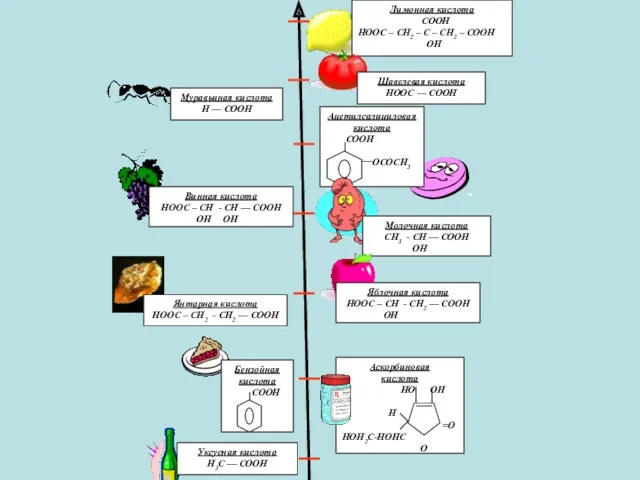
- 13. НАХОЖДЕНИЕ В ПРИРОДЕ
- 14. Муравьиная кислота (метановая кислота) Муравьиная кислота присутствует также в тончайших волосках крапивы, в пчелином яде, сосновой
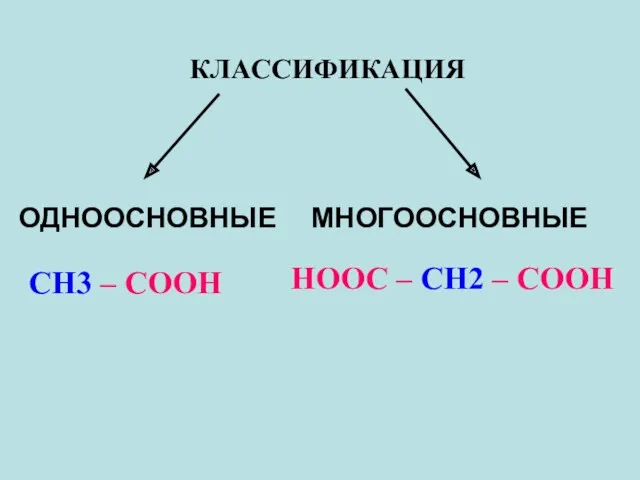
- 17. КЛАССИФИКАЦИЯ ОДНООСНОВНЫЕ МНОГООСНОВНЫЕ СН3 – COOH HOOC – СН2 – COOH
- 18. КЛАССИФИКАЦИЯ ПРЕДЕЛЬНЫЕ С2Н5СООН пропановая кислота НЕПРЕДЕЛЬНЫЕ С2Н3СООН пропеновая кислота
- 19. КЛАССИФИКАЦИЯ ПРЕДЕЛЬНЫЕ С17Н35СООН СТЕАРИНОВАЯ КИСЛОТА НЕПРЕДЕЛЬНЫЕ С17Н33СООН ОЛЕИНОВАЯ КИСЛОТА С17Н31СООН ЛИНОЛЕВАЯ КИСЛОТА С17Н29СООН ЛИНОЛЕНОВАЯ КИСЛОТА
- 20. ФИЗИЧЕСКИЕ СВОЙСТВА
- 21. С1 – С3 С4 – С9 C10 и > Жидкости с характерным резким запахом, хорошо растворимые
- 22. «ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ» цель: изучить свойства карбоновых кислот
- 23. НСООН формиат СН3СООН ацетат
- 24. НСООН формиат СН3СООН ацетат
- 25. НСООН формиат СН3СООН ацетат
- 26. 1.Молекулы кислот в водном растворе диссоциируют CH3COOH → H+ + CH3COO-
- 27. 2.Кислоты реагируют с металлами 2CH3COOH + Mg → (CH3COO)2Mg + H2↑ ацетат магния
- 28. 3. Кислоты реагируют с основными и амфотерными оксидами 2CH3COOH + MgO→ (CH3COO)2Mg + H2O
- 29. 4. Кислоты реагируют с гидроксидами CH3COOH + NaOH → CH3COONa + H2O
- 30. 5. Кислоты реагируют с солями более слабых и летучих кислот CH3COOH + NaHСО3 → CH3COONa +
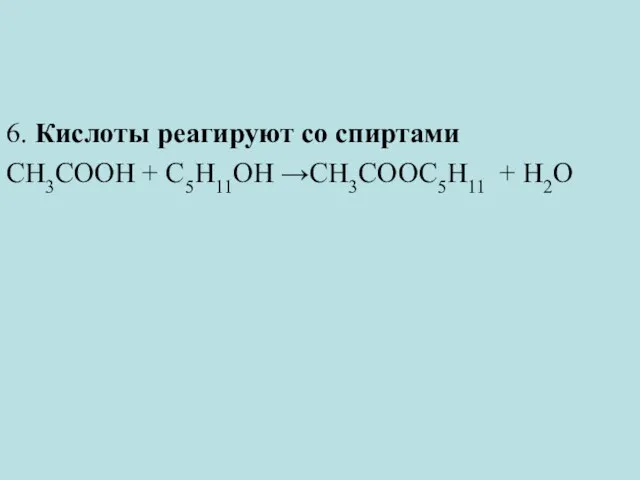
- 31. 6. Кислоты реагируют со спиртами CH3COOH + С5Н11ОН →CH3COOС5Н11 + H2O
- 32. 6. Муравьиная кислота подобно альдегидам легко окисляется (реакция «серебряного зеркала») НСООН + Ag2О → НОСООН +
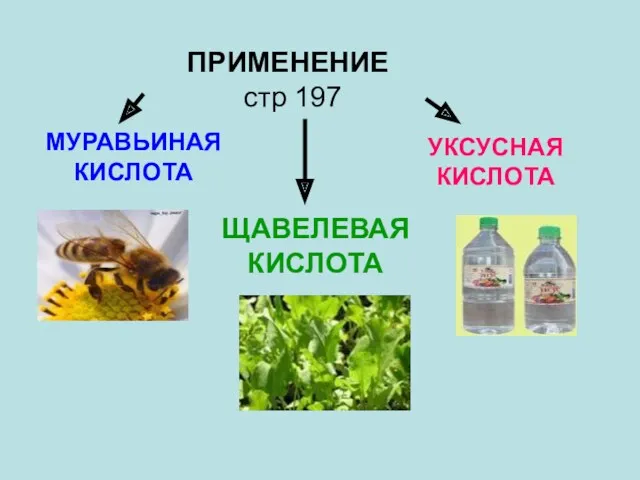
- 33. ПРИМЕНЕНИЕ стр 197 МУРАВЬИНАЯ КИСЛОТА УКСУСНАЯ КИСЛОТА ЩАВЕЛЕВАЯ КИСЛОТА
- 34. Муравьиная кислота: в текстильной промышленности (в качестве протравы при крашении тканей); в кожевенной (при дублении кож);
- 35. Уксусная кислота: в пищевой промышленности (для консервации); для получения полимеров, красителей, сложных эфиров, ацетатного шелка, негорючей
- 37. Скачать презентацию



























 Теобромин
Теобромин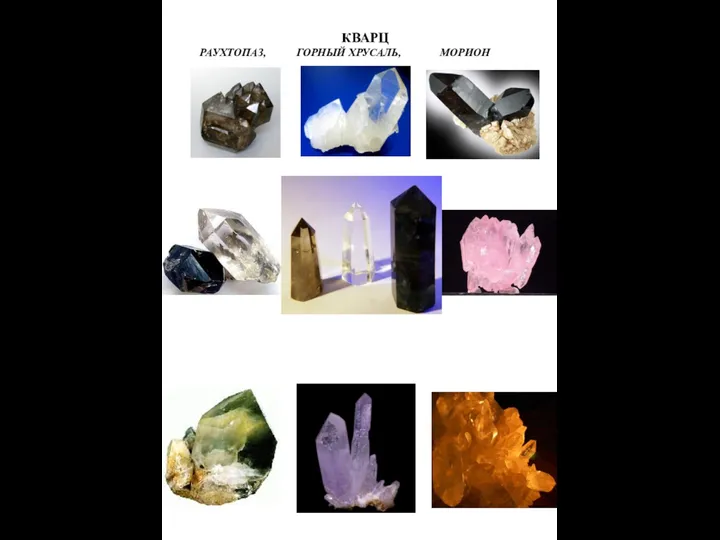 Кварц
Кварц Титриметрический метод анализа
Титриметрический метод анализа Будова електронних оболонок атомів
Будова електронних оболонок атомів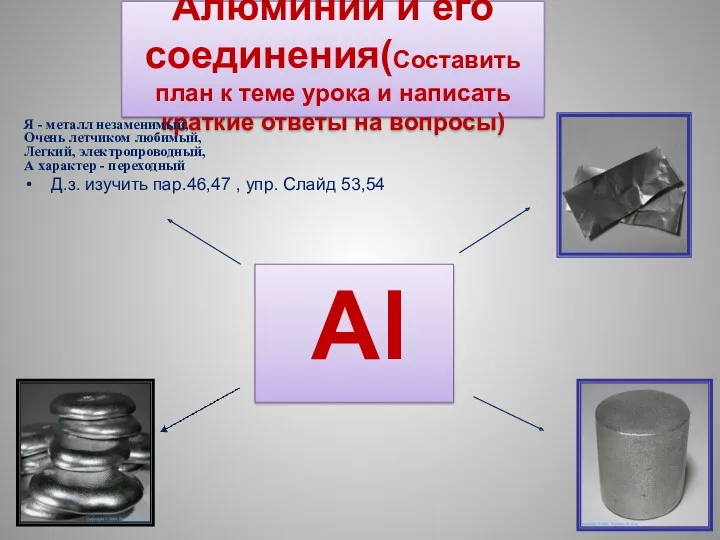 Алюминий и его соединения
Алюминий и его соединения Алкадиены
Алкадиены Химический элемент гелий
Химический элемент гелий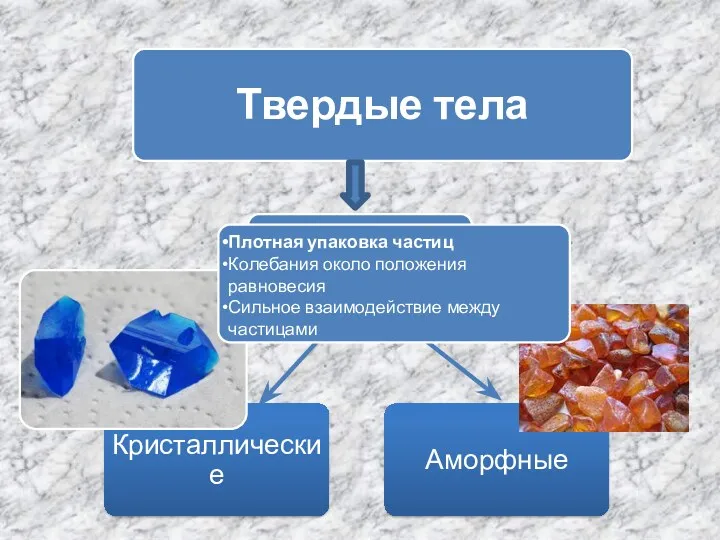 Твердые тела - кристаллические и аморфные
Твердые тела - кристаллические и аморфные Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка
Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Кристаллические решетки
Кристаллические решетки Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Коррозия металлов
Коррозия металлов Распределение элементов на Земле и в космосе
Распределение элементов на Земле и в космосе Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Аспирин: польза или вред?
Аспирин: польза или вред? Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Электролиз – ОВ процесс
Электролиз – ОВ процесс Минералы и их свойства
Минералы и их свойства Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Химический состав клетки
Химический состав клетки Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства