Содержание
- 2. План лекции: 1. Общие вопросы аналитической химии. 2. Литература по аналитической химии. 3. Химические методы обнаружения
- 3. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
- 4. КОНСПЕКТ В ИНТЕРНЕТЕ
- 5. Определение предмета «Аналитическая химия»
- 6. Аналитическая химия, или аналитика – это раздел химической науки, разрабатывающий на основе фундаментальных законов химии и
- 7. Определение VIII Европейской конференции по аналитической химии (Эдинбург, 1993)- Аналитическая химия – это научная дисциплина, которая
- 8. Определение по Г.Кристиану со ссылкой на Чарльза Н.Рейли Аналитическая химия – это то, чем занимаются химики-
- 9. Аналитическая служба Административная система, обеспечивающая конкретный анализ определенных объектов с использованием методов, рекомендуемых аналитической химией, называется
- 10. СТРУКТУРА ДИСЦИПЛИНЫ «АНАЛИТИЧЕСКАЯ ХИМИЯ» 1) КАЧЕСТВЕННЫЙ (QUALITY) АНАЛИЗ; 2) КОЛИЧЕСТВЕННЫЙ (QUANTITY) АНАЛИЗ; 3) ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- 11. ОСНОВНАЯ ЦЕЛЬ КУРСА АХ ОБЩЕОБРАЗОВАТЕЛЬНЫЙ ПРЕДМЕТ, НУЖНЫЙ ВПОСЛЕДСТВИИ ПРИ ИЗУЧЕНИИ ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
- 12. Основные понятия аналитической химии: принцип, метод и методика анализа
- 13. Принцип анализа Явление, используемое для получения аналитической информации, называется принципом анализа. (Например, явление - поглощение света
- 14. Метод анализа Краткое изложение принципов, лежащих в основе анализа вещества (вне зависимости от определяемого компонента и
- 15. Методика анализа Методика анализа – это подробное описание хода выполнения конкретного анализа данного объекта с использованием
- 16. В зависимости от цели различают качественный, количественный и структурный анализ.
- 17. Качественный анализ Качественный анализ предполагает обнаружение или идентификацию компонентов анализируемого образца.
- 18. Структурный анализ (ОДНА ИЗ РАЗНОВИДНОСТЕЙ КАЧЕСТВЕННОГО АНАЛИЗА) Цель структурного анализа – установление химического и пространственного строения
- 19. Количественный анализ В процессе количественного анализа происходит определение концентраций или масс компонентов.
- 20. Классификация видов анализа в зависимости от определяемого компонента
- 21. Классификация видов анализа в зависимости от массы или объема анализируемой пробы
- 22. Классификация видов анализа в зависимости от процедуры проведения анализа Систематический –разделение смеси ионов на группы или
- 23. Характеристики аналитической реакции Избирательность ( селективность) – возможность определения в результате аналитической реакции определенного вещества (одного
- 24. Избирательность аналитической реакции (в зависимости от числа веществ) Специфические реакции – позволяют определять только одно вещество;
- 25. ПРЕДЕЛ ОБНАРУЖЕНИЯ НАИМЕНЬШЕЕ СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА) КОТОРОЕ ПО ДАННОЙ МЕТОДИКЕ МОЖНО ОТЛИЧИТЬ ОТ СИГНАЛА КОНТРОЛЬНОГО
- 26. ПРЕДЕЛ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЕ АНАЛИТА (ОПРЕДЕЛЯЕМОГО ВЕЩЕСТВА) КОТОРЫЙ ПРЕВЫШАЕТ СРЕДНЕЕ ЗНАЧЕНИЕ СИГНАЛА КОНТРОЛЬНОГО ОПЫТА НА ВЕЛИЧИНУ В
- 27. ДИАПАЗОН ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ РАЗНОСТЬ МЕЖДУ НИЖНЕЙ И ВЕРХНЕЙ ГРАНИЦАМИ ОПРЕДЕЛЯЕМЫХ СОДЕРЖАНИЙ.
- 28. Методы аналитической химии
- 29. Методы аналитической химии при анализе образцов 1. Метод пробоотбора; 2. Метод разложения проб; 3. Метод разделения
- 30. Химические методы обнаружения неорганических веществ.
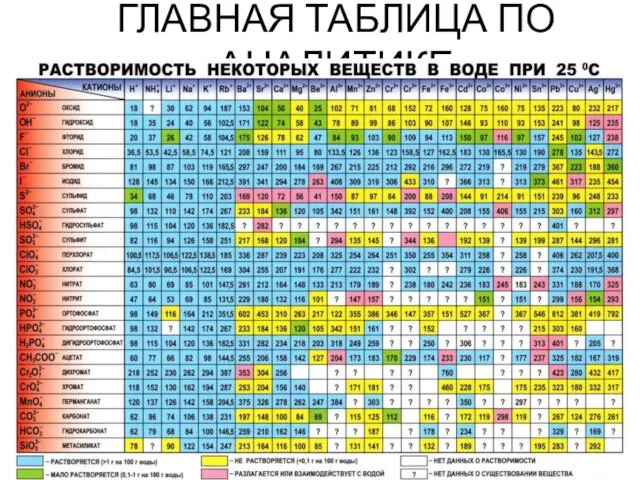
- 31. ГЛАВНАЯ ТАБЛИЦА ПО АНАЛИТИКЕ
- 32. Химические методы обнаружения неорганических веществ основаны на проведении аналитических реакций. Аналитическими называются химические реакции, результат которых
- 33. Эффекты при аналитических реакциях 1. Образование и растворение осадков 2. Образование характерных кристаллов 3. Появление или
- 34. Понятие аналитической группы ионов
- 35. Понятие аналитической группы ионов Аналитическая группа ионов отличается от групп Периодической таблицы Менделеева Д.И. Аналитическая группа
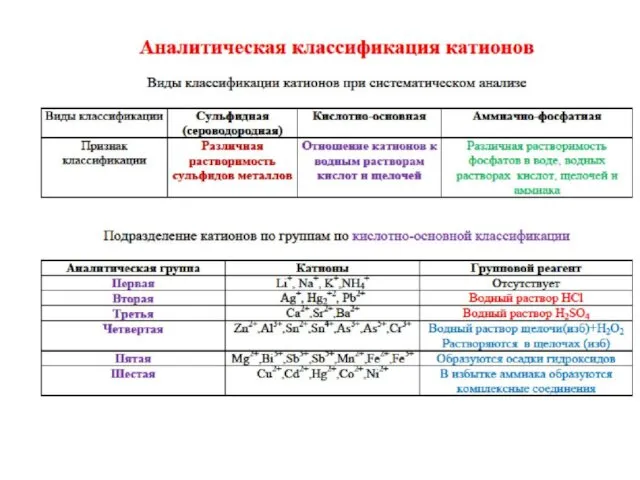
- 36. Аналитическая классификация катионов
- 38. Аналитическая классификация катионов Сульфидная; Кислотно-основная; Аммиачно-фосфатная;
- 39. АНАЛИТИЧЕСКИЕ ГРУППЫ ИОНОВ 6 ГРУПП КАТИОНОВ ПО КИСЛОТНО-ОСНОВНОЙ КЛАССИФИ-КАЦИИ 3 ГРУППЫ АНИОНОВ ПО РАСТВОРИ-МОСТИ СОЛЕЙ БАРИЯ
- 41. Сульфидная Аналитическая классификация катионов Групповые реагенты – сульфид аммония, сероводород и карбонат аммония. Все катионы подразделяются
- 42. Кислотно-основная аналитическая классификация катионов Все катионы подразделяются на 6 аналитических групп. Используется различие в растворимости соединений
- 43. Аммиачно-фосфатная аналитическая классификация катионов В основу положена различная растворимость фосфатов в воде, водных растворах кислот, щелочей
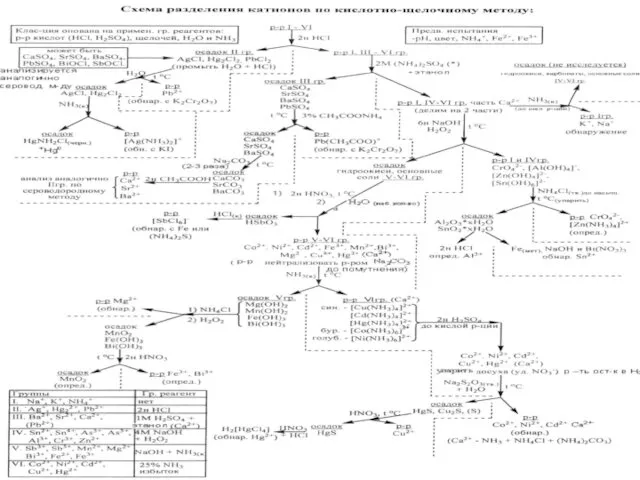
- 44. АНАЛИЗ КАТИОНОВ (ПО Кислотно-основной классификация)
- 45. МЕШАЮЩЕЕ ВЛИЯНИЕ ИОНОВ Li+ (Na+) + Zn(UO2)3CH3COO-=
- 46. ПО ОТНОШЕНИЮ К ГРУППОВОМУ РЕАГЕНТУ НЕ ИМЕЮТ ГРУППОВОГО РЕАГЕНТА ИМЕЮТ ГРУППОВОЙ РЕАГЕНТ
- 47. Подразделение катионов по группам по кислотно-основной классификации
- 48. ИМЕЮТ ГРУППОВОЙ РЕАГЕНТ КИСЛОТЫ НЕРАСТВОРМЫЕ ХЛОРИДЫ – HCl - Ag+,, Hg22+,, Pb2+, НЕРАСТВОРИМЫЕ СУЛЬФАТЫ- H2SO4 (NH4)2SO4-
- 49. ОСОБОЕ ПОВЕДЕНИЕ Pb2+, . ρ*(PbСl2)=9,8 г/л ρ*(PbSO4)= 0,045 г/л Вывод Рb2+, можно отнести и ко II,
- 50. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
- 51. Реакции ионов Li+
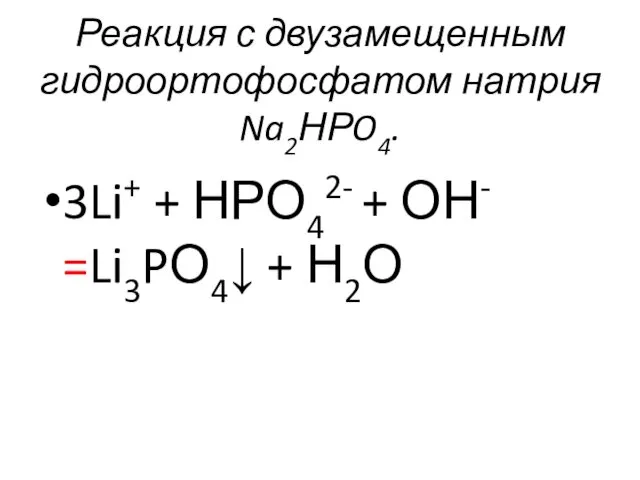
- 52. Реакция с двузамещенным гидроортофосфатом натрия Na2НРO4. 3Li+ + НРО42- + ОН- =Li3PО4↓ + Н2О
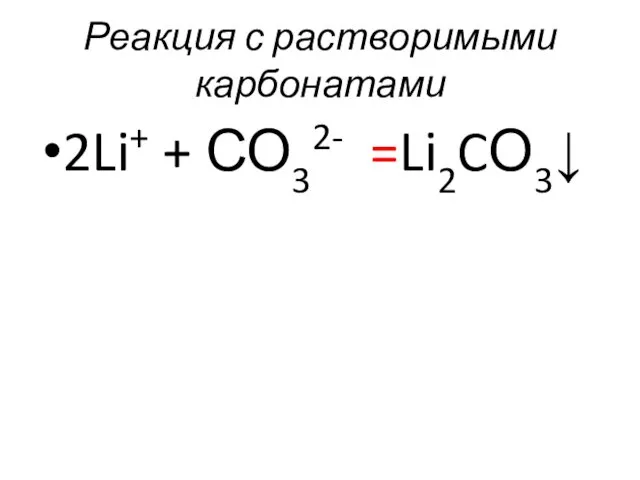
- 53. Реакция с растворимыми карбонатами 2Li+ + СО32- =Li2CО3↓
- 54. Реакция с растворимыми фторидами Li+ + F- = LiF↓
- 55. Реакции ионов Na+
- 56. Микрокристаллоскопическая реакция с цинкуранилацетатом (уже не фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О
- 57. .Реакция с гексагидроксостибатом (V) калия Na+ + [Sb(OH)6]- =Na[Sb(OH)6]↓
- 58. Реакции ионов K+
- 59. Реакция с гексанитрокобальтатом (III) натрия кобальтинитритом натрия (фармакопейная) 2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ + 2Na+.
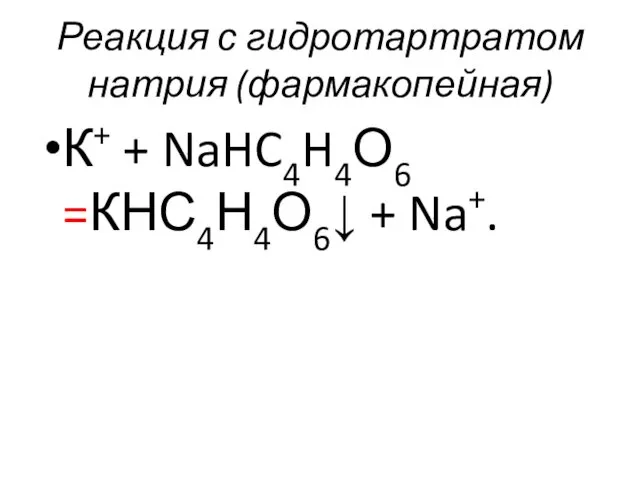
- 60. Реакция с гидротартратом натрия (фармакопейная) К+ + NaHC4H4О6 =КНС4Н4О6↓ + Na+.
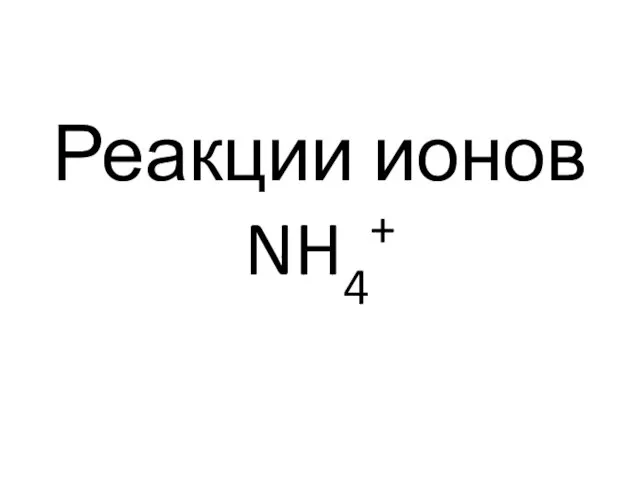
- 61. Реакции ионов NH4+
- 62. Реакция разложения солей аммония щелочами (фармакопейная) NH4+ + ОН- =NH3↑ + Н2О.
- 63. Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4] с КОН (фармакопейная) NH4+ + 2[HgI4]2-
- 64. Систематический анализ смеси катионов Li+, Na+, K+, NH4+ Сразу удаляют аммоний прокаливаем в щелочной среде, затем
- 65. Вторая аналитическая группа катионов -Ag+, Pb2+, Hg22+,
- 66. Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О
- 67. Реакции ионов Ag+
- 68. Реакция со щелочами 2Ag+ + 2ОН- Ag2O↓ + Н2О. Ag2O + 4NH3 + Н2О 2[Ag(NH3)2]+ +
- 69. Растворимые галогениды Ag+ + Сl- = AgCl↓; Ag+ + Br- = AgBr↓; Ag+ + I- =
- 70. Различие галогенидов серебра Осадок хлорида серебра растворим в растворе аммиака. Иодид серебра не растворяется в растворе
- 71. Хромат калия - осадок кирпично-красного цвета: 2Ag+ + CrО42- = Ag2CrО4↓
- 72. Гидрофосфат натрия 3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4-
- 73. Реакция восстановления Ag+ до металлического серебра 4[Ag(NH3)2]OH + CH2O = 4Ag↓ + (NH4)2CO3 + 6NH3 +
- 74. Реакции ионов Pb2+
- 75. Действие щелочей и аммиака Pb2+ + 2OH- = Pb(OH)2 ↓
- 76. Растворимые галогениды Pb2+ +2Cl - = PbCl2 ↓ Pb2+ +2Br - = PbBr2 ↓ Pb2+ +2I
- 77. Осадки галогенидов свинца (II) растворимы в горячей воде и в присутствии избытка галогенид-ионов PbI2↓ + 2I-
- 78. Хромат калия образует желтый осадок Pb2+ + CrO42- = PbCrO4 ↓
- 79. Реакция с сульфид-ионами Pb2+ + S2- = PbS ↓
- 80. Реакции ионов Hg22+
- 81. Действие щелочей Hg22+ + 2OH- = Hg2O↓ + H2O
- 82. Водный раствор аммиака 2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.
- 83. Растворимые хлориды Hg22+ + 2Сl- = Hg2Cl2↓ (каломель).
- 84. Растворимые иодиды Hg22+ + 2I- = Hg2I2↓.
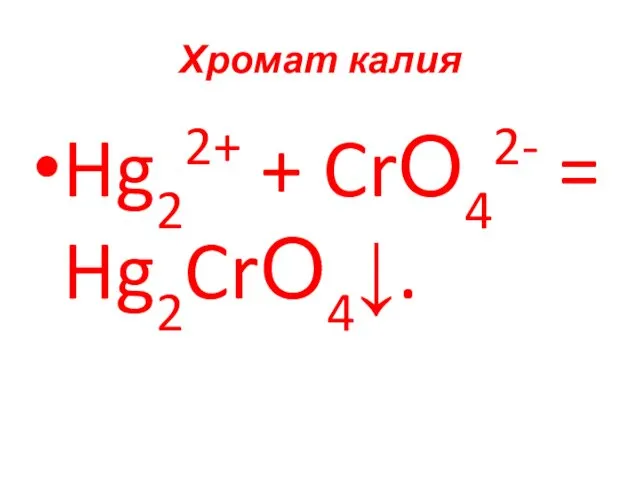
- 85. Хромат калия Hg22+ + CrО42- = Hg2CrО4↓.
- 86. Восстановление ртути (I) до металлической ртути. Hg22+ + Сu = 2Hg↓ + Сu2+.
- 87. Третья аналитическая группа катионов -Ca2+ , Sr2+, Ba2+,
- 88. Реакции ионов Ca2+
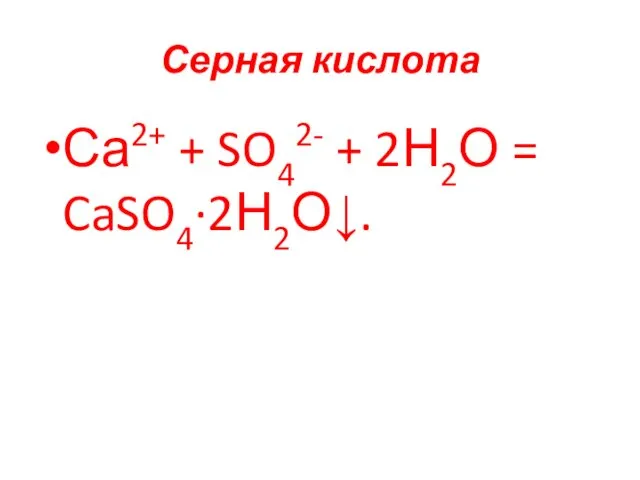
- 89. Серная кислота Са2+ + SO42- + 2Н2О = CaSO4∙2Н2О↓.
- 90. Карбонат аммония Са2+ + СO32- = СаСO3↓.
- 91. Оксалат аммония Са2+ + С2O42- = СаС2О4↓
- 92. Гексацианоферрат (II) калия Са2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.
- 93. Реакции ионов Sr2+
- 94. Серная кислота, растворимые сульфаты и гипсовая вода (насыщенный водный раствор сульфата кальция) Sr2++ SO42- = SrSO4↓.
- 95. Карбонат аммония Sr2+ + СО32- = SrCO3↓.
- 96. Оксалат аммония Sr2+ + С2O42- = SrC2O4↓.
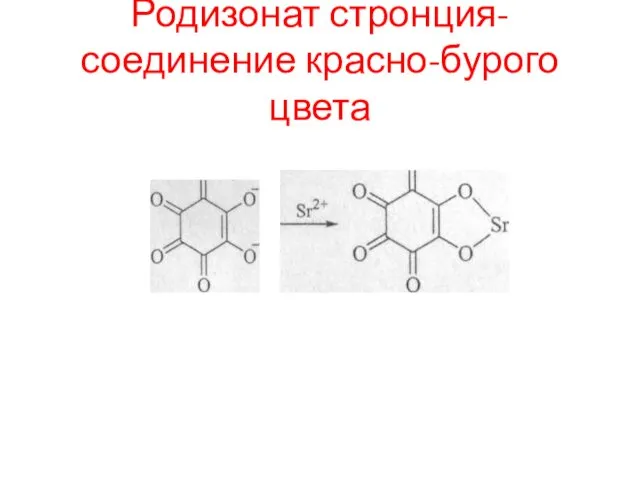
- 97. Родизонат стронция- соединение красно-бурого цвета
- 98. Реакции ионов Ba2+
- 99. Серная кислота и растворимые сульфаты Ва2+ + SO42- = BaSO4↓.
- 100. Карбонат аммония Ва2+ + СO32- = BaCO3↓.
- 101. Оксалат аммония Ва2+ + С2O42- = BaC2O4↓.
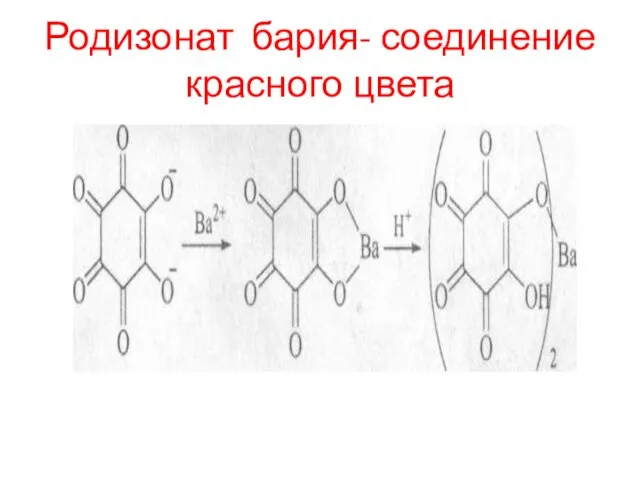
- 102. Родизонат бария- соединение красного цвета
- 103. Хромат или дихромат калия дают осадки ярко-желтого цвета Ва2+ + СгO42- = ВаСrO4↓; 2Ва2+ + Сг2O72-
- 104. СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА Третья аналитическая группа катионов
- 105. ПЕРЕВОД ОСАДКОВ В РАСТВОРИМОЕ СОСТОЯНИЕ СУЛЬФАТЫ КАТИНОВ III ГРУППЫ С СН3СООН НЕ ВЗАИМОДЕЙСТВУЮТ, ПОЭТОМУ ИХ ПРЕДВАРИТЕЛЬНО
- 106. ИДЕНТИФИКАЦИЯ КАТИОНА БАРИЯ ОБНАРУЖИВАЮТ РЕАКЦИЙ С K2Cr2O7 СН3СООNa, ОСАЖДАЮТ С K2CrO4 7 , СТРОНЦИЙ И КАЛЬЦИЙ
- 107. ОБНАРУЖЕНИЕ СТРОНЦИЯ И КАЛЬЦИЯ. РАЗДЕЛЕНИЕ ОСНОВАНИЕ НА ТОМ, ЧТО В НАСЫЩЕНОЙ РАСТВОРЕ (NH4)2SO4 [Ca(SO4)2]2-, ОБРАЗУЕТ РАСТВОРИМЫЙ
- 108. Анализ смеси катионов IVаналитической группы
- 109. Общая характеристика химических свойств
- 110. Катионы IV группы Al3+, Cr3+ , Zn2+ , Sn2+ , Sn (IV).
- 111. Основное свойство Амфотерность. В данном случае - это способность растворяться в щелочах с образованием гидроксокомплексов
- 112. Гидроксокомплексы при избытке NaOH [Al(OH)4]-, [Cr(OH)4]- , [Zn(OH)4]2-
- 113. Катионы в водных растворах Обладают выраженными кислотными свойствами; Бесцветны, за исключением [Cr(Н2O)6]3+ - серо-зеленого цвета
- 114. AL3+ характеристика химических свойств
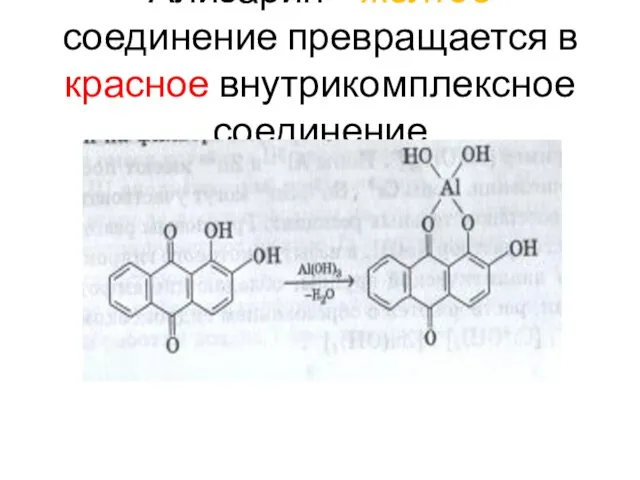
- 115. Ализарин – желтое соединение превращается в красное внутрикомплексное соединение
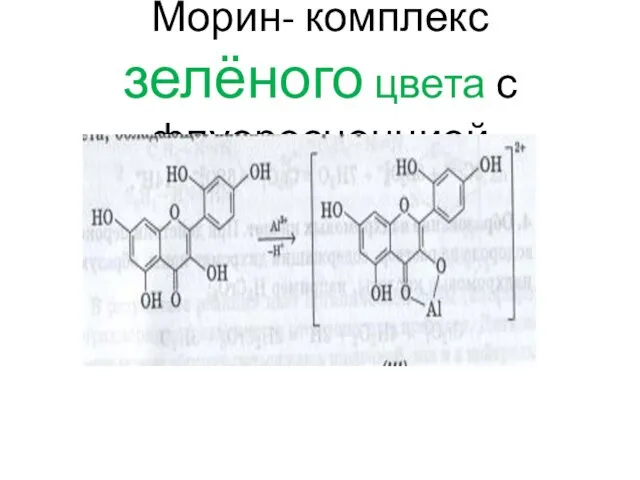
- 116. Морин- комплекс зелёного цвета с флуоресценцией
- 117. CR3+ характеристика химических свойств
- 118. АММИАКАТЫ ХРОМА ОРАНЖЕВОГО ЦВЕТА, n=6 , ОДНАКО РЕАКЦИЯ ПРОТЕКАЕТ КРАЙНЕ МЕДЛЕННО [Cr(NH3)6] 3+
- 119. Окисление Cr(III) до Cr(VI) Щелочная среда 2[Cr(OH)6]3- + 3H2O2 = 2CrO42- + 2OH- +8H2O Кислая среда
- 120. Образование надхромовых кислот Cr2O72- + 4H2O2 + 2H+ = 2H2Cr+6O6 + 3H2O
- 121. ПОЯСНЕНИЕ НАДКИСЛОТЫ- КИСЛОТЫ, В КОТОРЫХ ОДИН ИЛИ НЕСКОЛЬКО КИСЛОРОДОВ О2- ЗАМЕНЕН НА ПЕРОКСИДНУЮ ГРУППИРОВКУ О22-
- 122. ЭКСТРАКЦИЯ надхромовых кислот Экстргент -диэтиловый эфир , этилацетат – органическая фаза синего цвета
- 123. ZN2+ Общая характеристика химических свойств
- 124. Действие щелочей и аммиака Zn2+ + 2OH- = Zn(OH)2 ↓ Zn2+ + 2NH3 + 2H2O =
- 125. Реакция с сульфидом натрия – белый осадок Zn2+ + S2- = ZnS ↓
- 126. Реакция с дитизоном – цвет изменяется от зеленого до красного
- 127. ОСОБЕННОСТИ В ЩЕЛОЧНОЙ СРЕДЕ В КРАСНЫЙ ЦВЕТ ОКРАШЕНЫ ОБЕ ФАЗЫ
- 128. Гекса циано феррит калия Гекса циано феррaт (II) калия - ОСАДОК БЕЛОГО ЦВЕТА 3Zn2+ + 2K+
- 129. SN2+ И SN(IV) характеристика химических свойств
- 130. Реакции сульфид-ионов Sn2+ + S2- = SnS ↓ (бурый) [SnCl6]2-+H2S= 6Cl-+2H++ SnS2↓(желтый)
- 131. Реакции окисления-восстановления
- 132. Анализ смеси катионов IV аналитической группы по систематическому анализу
- 133. ОБНАРУЖЕНИЕ ХРОМА ЧЕРЕЗ ОКИСЛЕНИЕ Н2О2 В ЩЕЛОЧНОЙ СРЕДЕ. ОБРАЗУЕТСЯ ЖЕЛТЫЙ ХРОМАТ
- 134. ВЫДЕЛЕНИЕ Al+3 И Sn (IV) В ВИДЕ ГИДРОКСИДОВ ПЕРЕВОД В ОСАДКИ ГИДРОКСИДОВ ПРИ ОБРАБОТКЕ NH4Cl (КИСЛАЯ
- 135. РАСТВОРЕНИЕ ОСАДКОВ И АНАЛИЗ РАСТВОРЯЮТ ОСАДКИ В 2 М HCl И ОБНАРУЖИВАЮТ Al+3 И Sn (IV)
- 136. ПЕРЕВОД ЦИНКА В ОСАДОК – (ZnOH)2CO3 ОБРАБОТКА Na2CO3
- 138. Скачать презентацию















































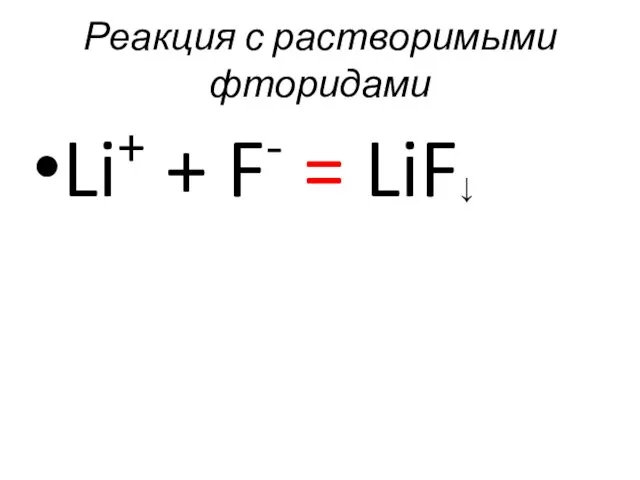
![Микрокристаллоскопическая реакция с цинкуранилацетатом (уже не фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-55.jpg)
![.Реакция с гексагидроксостибатом (V) калия Na+ + [Sb(OH)6]- =Na[Sb(OH)6]↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-56.jpg)

![Реакция с гексанитрокобальтатом (III) натрия кобальтинитритом натрия (фармакопейная) 2К+ + Na3[Co(NО2)6] = NaK2[Co(NО2)6↓ + 2Na+.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-58.jpg)

![Реакция с реактивом Несслера — смесью раствора тетрайодомеркурama(II) калия K2[HgI4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-62.jpg)


![Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Na+ + Zn[(UО2)3(CH3CОО)8] + СН3СОО- + 9Н2О =NaZn(UО2)3(CH3CОО)9∙9Н2О](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-65.jpg)






![Реакция восстановления Ag+ до металлического серебра 4[Ag(NH3)2]OH + CH2O =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-72.jpg)








![Водный раствор аммиака 2Hg22+ + 4NH3 + Н2О = [OHg2NH2]+ + 2Hg↓ + 3NH4+.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-81.jpg)







![Гексацианоферрат (II) калия Са2+ + К+ + NH4++ [Fe(CN)6]4- = NH4KCa[Fe(CN)6]↓.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-91.jpg)
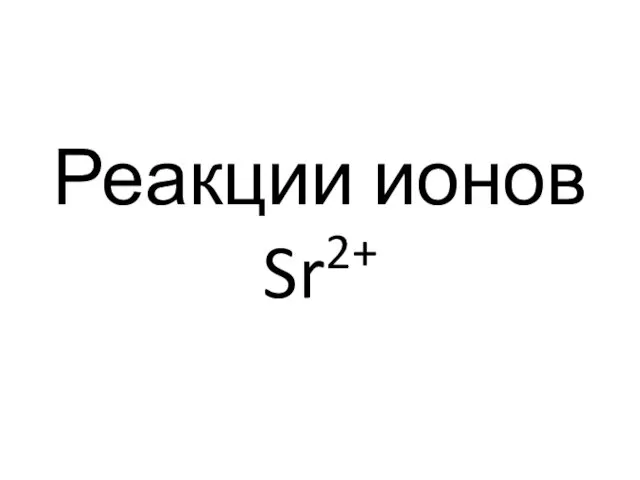















![Гидроксокомплексы при избытке NaOH [Al(OH)4]-, [Cr(OH)4]- , [Zn(OH)4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-111.jpg)
![Катионы в водных растворах Обладают выраженными кислотными свойствами; Бесцветны, за исключением [Cr(Н2O)6]3+ - серо-зеленого цвета](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-112.jpg)


![АММИАКАТЫ ХРОМА ОРАНЖЕВОГО ЦВЕТА, n=6 , ОДНАКО РЕАКЦИЯ ПРОТЕКАЕТ КРАЙНЕ МЕДЛЕННО [Cr(NH3)6] 3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-117.jpg)
![Окисление Cr(III) до Cr(VI) Щелочная среда 2[Cr(OH)6]3- + 3H2O2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-118.jpg)










![Реакции сульфид-ионов Sn2+ + S2- = SnS ↓ (бурый) [SnCl6]2-+H2S= 6Cl-+2H++ SnS2↓(желтый)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108774/slide-129.jpg)






 Оксид водорода (H2O)
Оксид водорода (H2O) Аллотропные модификации кремния
Аллотропные модификации кремния Способи очищення води в побуті
Способи очищення води в побуті Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Синтетические каучуки: хлоропреновый каучук
Синтетические каучуки: хлоропреновый каучук Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Химическая кинетика
Химическая кинетика Металлы и неметаллы
Металлы и неметаллы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Органикалық қосылыстар
Органикалық қосылыстар Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химические свойства серной кислоты
Химические свойства серной кислоты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Реакции ионного обмена
Реакции ионного обмена Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Классификация химических реакций. Признаки химических реакций
Классификация химических реакций. Признаки химических реакций Классы неорганических соединений
Классы неорганических соединений Химическая промышленность России
Химическая промышленность России Галогенопроизводные углеводородов
Галогенопроизводные углеводородов ПВХ
ПВХ Вугдеводи. Моносахариди
Вугдеводи. Моносахариди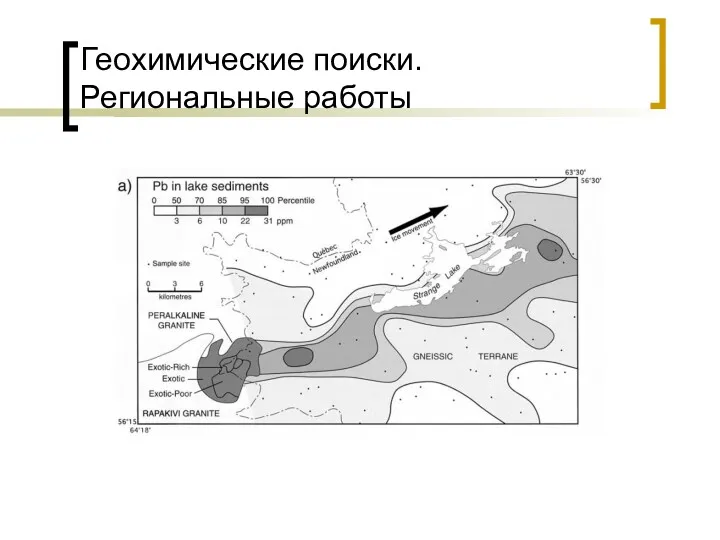 Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Соединения алюминия
Соединения алюминия Альтернативная бытовая химия
Альтернативная бытовая химия Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены