*
Тема: Реакции ионного обмена.
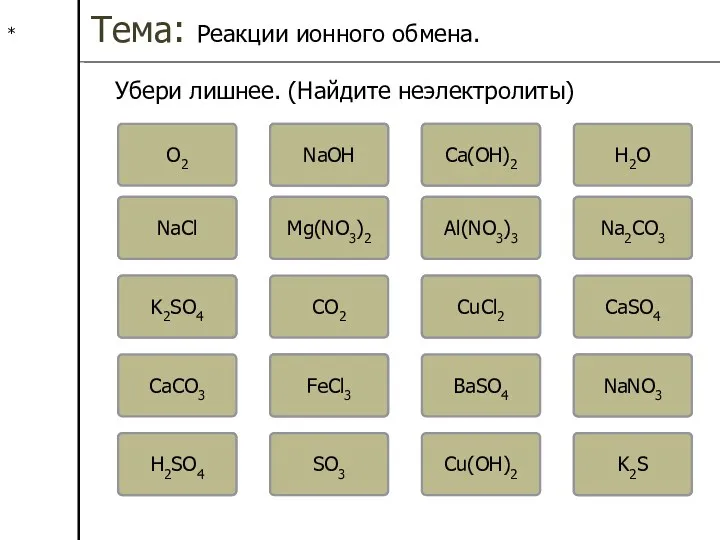
I. РИО (реакции ионного обмена) – это реакции
протекающие между электролитами.
Пример: Взаимодействие хлорида бария с сульфатом натрия.
BaCl2 + Na2SO4 ? BaSO4 + NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
1. Записать уравнение реакции в молекулярном виде.
Порядок действий:
2. Расставить коэффициенты.
2
3. По таблице растворимости, определить нерастворимые вещества. Обозначить их стрелкой вниз.
4. Составить полное ионное уравнение (растворимые вещества расписать на ионы.
?
BaSO4
+
2Na+
+
2Cl-
5. Сократить одинаковые ионы в левой и правой части полного ионного уравнения.
6. Составить сокращенное ионное уравнение.
Ba2+
+
SO42-
?
BaSO4



 Водород H2
Водород H2 Способы выражения концентрации растворов
Способы выражения концентрации растворов Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Кристалдану үдерісі және қолдланылатын аппараттар
Кристалдану үдерісі және қолдланылатын аппараттар Серная кислота H2SO4
Серная кислота H2SO4 Физические и химические явления
Физические и химические явления Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма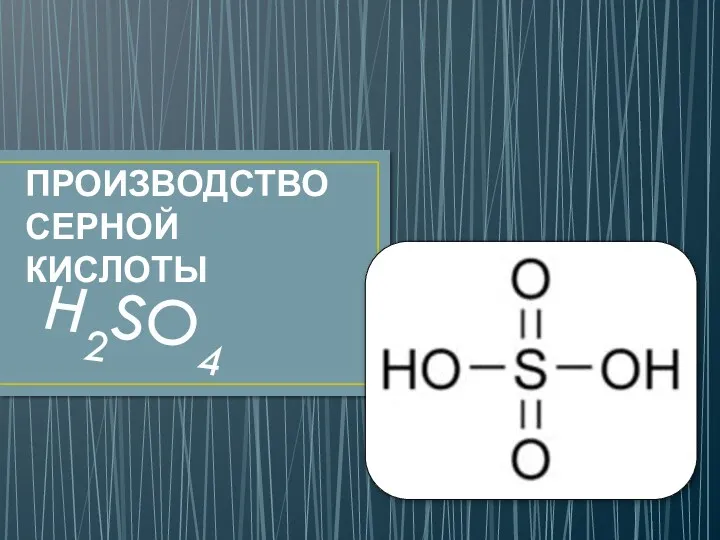 Производство серной кислоты
Производство серной кислоты яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Азотсодержащие гетероциклические соединения. Пиррол
Азотсодержащие гетероциклические соединения. Пиррол Математические модели химических реакторов
Математические модели химических реакторов Основные законы химии
Основные законы химии Чипсы: вред или польза
Чипсы: вред или польза Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Азотная кислота и ее свойства
Азотная кислота и ее свойства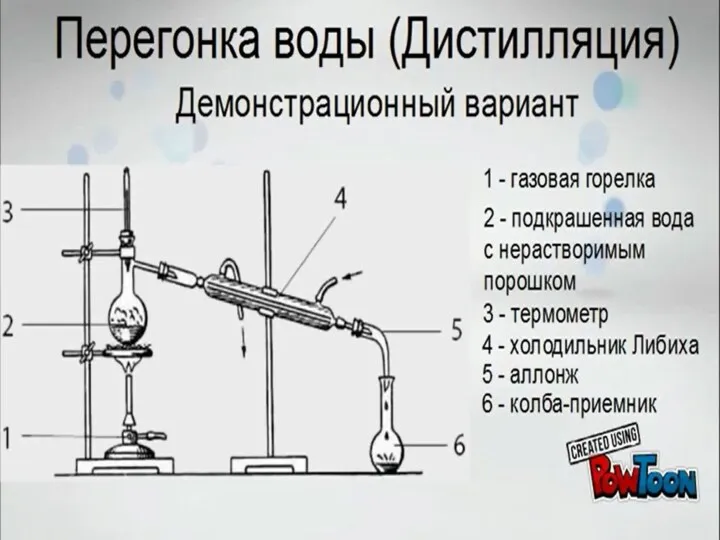 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Молярный объем газов
Молярный объем газов Вывод формул веществ по массовым долям элементов. 10 класс
Вывод формул веществ по массовым долям элементов. 10 класс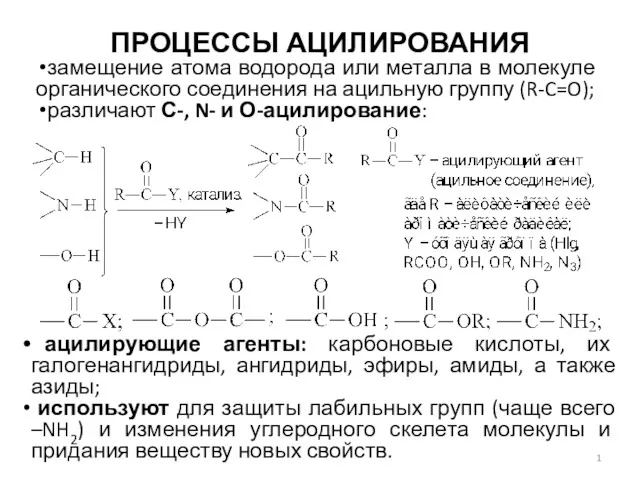 Процессы ацилирования
Процессы ацилирования Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Значення води і водних розчинів у природі та житті людини. Кислотні дощі
Значення води і водних розчинів у природі та житті людини. Кислотні дощі Бытовая химическая грамотность
Бытовая химическая грамотность Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Мыла и синтетические моющие срдства
Мыла и синтетические моющие срдства Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии