Содержание
- 2. Растворы Растворы- гомогенные системы переменного состава, состоящие как минимум из двух компонентов – растворенного вещества и
- 3. Концентрация Количественный состав раствора оценивают с помощью концентрации, т.е. содержания растворенного вещества в единице массы или
- 4. Способы выражения концентрации 1. Массовая доля вещества ω – отношение массы данного компонента раствора к общей
- 5. Способы выражения концентрации 2. Молярная концентрация раствора С (молярность) − это отношение количества растворённого вещества n(х)
- 6. Способы выражения концентрации 3. Молярная концентрация эквивалента С( x) (нормальность) − это отношение количества эквивалентов растворённого
- 7. Химический эквивалент Масса одного моль эквивалента называется молярной массой эквивалента М( x). Доля реальной частицы вещества,
- 8. Если не указывается реакция, для которой рассчитывается эквивалент, учитывают максимальное число зарядов, которые могут принять участие
- 9. Способы выражения концентрации 4. Титр Т(x) – это отношение массы растворённого вещества в г к объёму
- 10. Связь между видами концентраций Используя вышеприведенные формулы, легко пересчитать с одного вида концентрации на другую. Для
- 11. Решение задач на приготовление раствора заданного состава Задача 1. Приготовить 200 мл 5% раствора NaCl (ρ
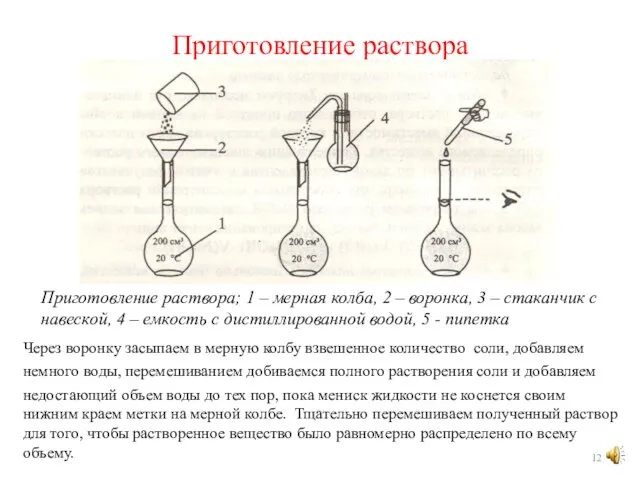
- 12. Приготовление раствора Приготовление раствора; 1 – мерная колба, 2 – воронка, 3 – стаканчик с навеской,
- 13. Решение задач на приготовление раствора заданного состава Задача 2. Приготовить 250 мл раствора сульфата меди (II)
- 14. Решение задач на приготовление раствора заданного состава Задача 3. Приготовить 250 мл 0,1 М раствора H2SO4
- 15. Решение задач на приготовление раствора заданного состава Задача 4. Для обработки ран, порезов, слизистой оболочки используют
- 16. Решение задач на приготовление раствора заданного состава Задача 5. Приготовить 100 мл раствора НС1 с C(HCl)
- 17. Задачи на пересчет с одного вида концентрации на другой. Задача 6. Найти молярную концентрацию эквивалента 10%
- 19. Скачать презентацию















 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов