Содержание
- 2. Термохимия Термохимические уравнения Термохимическая и термодинамическая система знаков Измерение тепловых эффектов химических реакций Закон Гесса Следствия
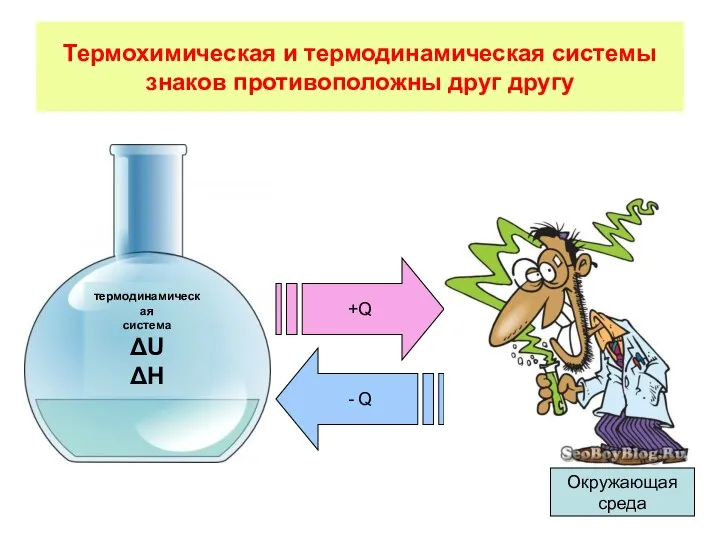
- 3. Термохимическая и термодинамическая системы знаков противоположны друг другу термодинамическая система ΔU ΔH +Q - Q
- 4. Термохимические уравнения
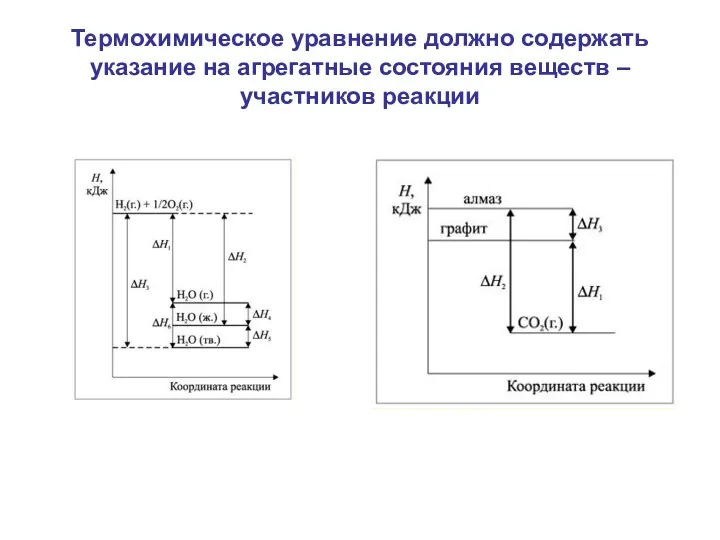
- 5. Термохимическое уравнение должно содержать указание на агрегатные состояния веществ – участников реакции
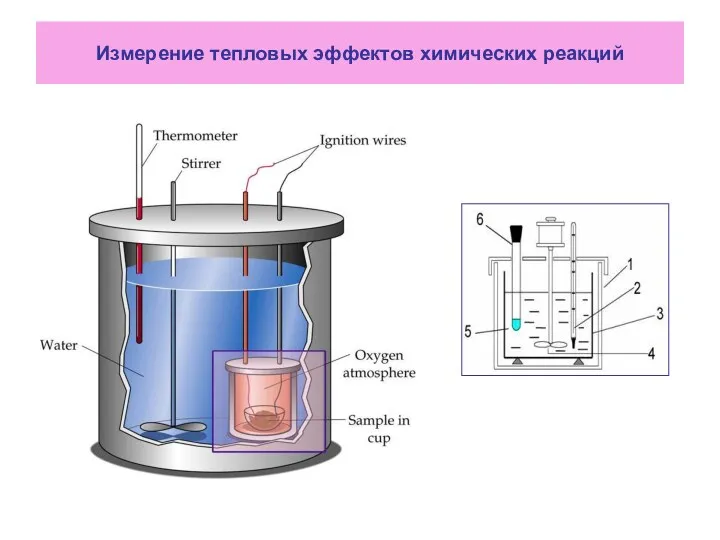
- 6. Измерение тепловых эффектов химических реакций
- 7. В химической лаборатории кафедры ОиСХ ИАТЭ НИЯУ МИФИ
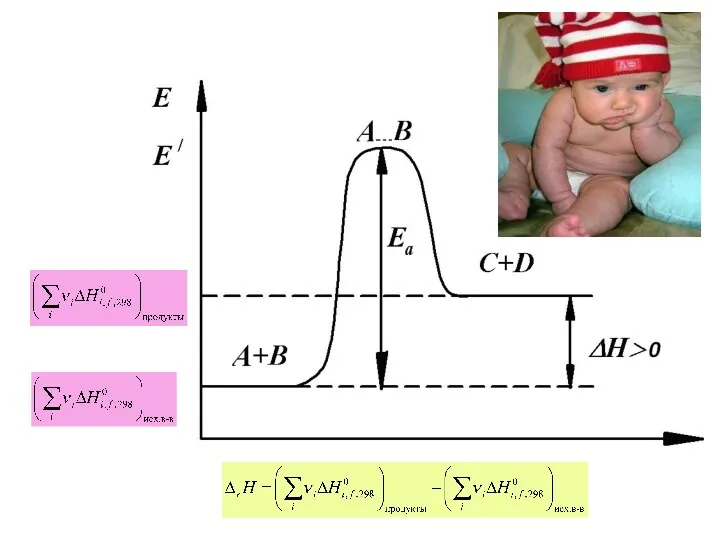
- 8. Следствия первого закона термодинамики Новая функция состояния системы – ЭНТАЛЬПИЯ (теплосодержание) Для изобарно-изотермических и изохорно-изотермических процессов
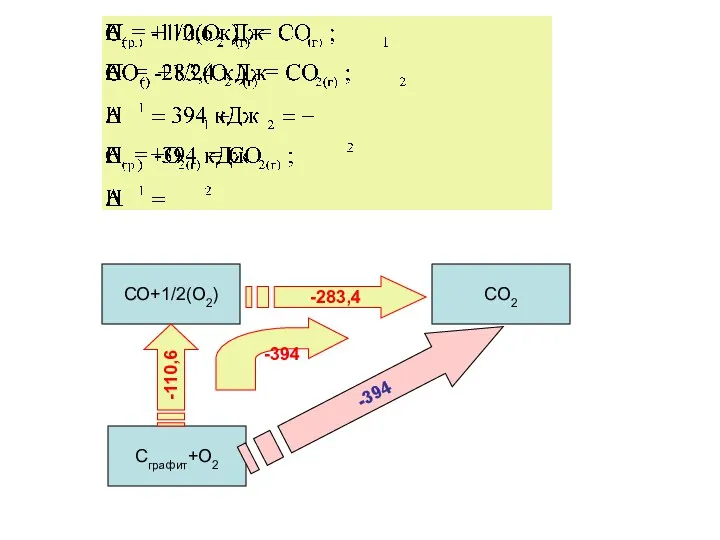
- 9. Закон Гесса Тепловой эффект химической реакции, проводимой при P=const или V=const не зависит от пути проведения
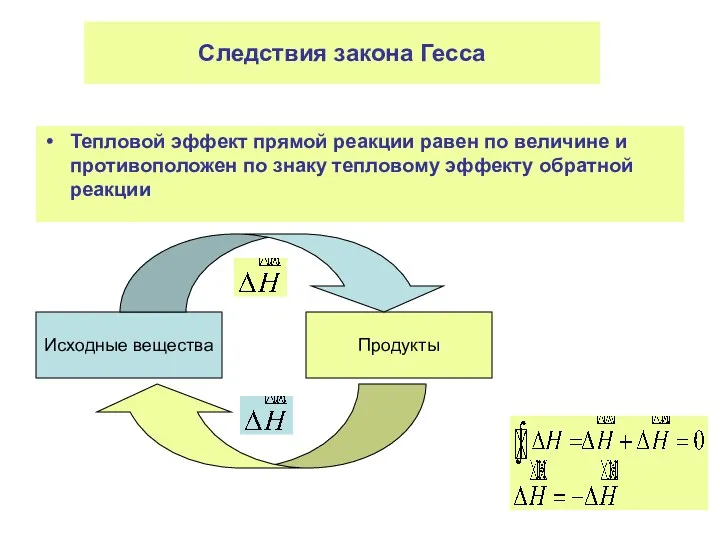
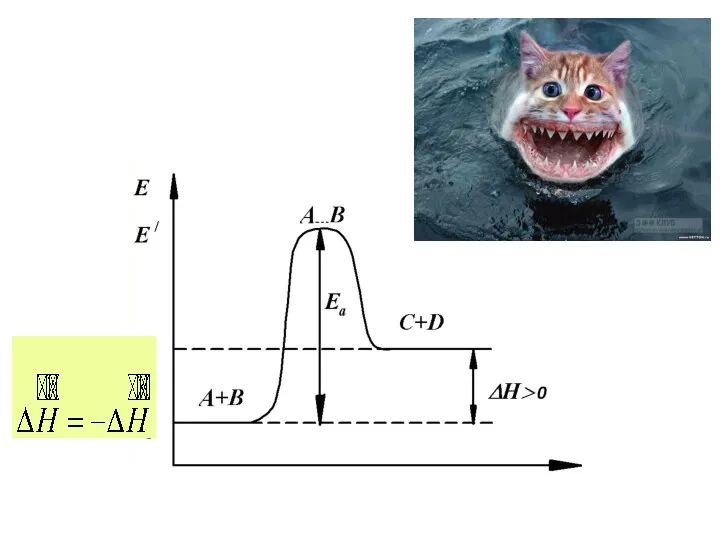
- 11. Следствия закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту
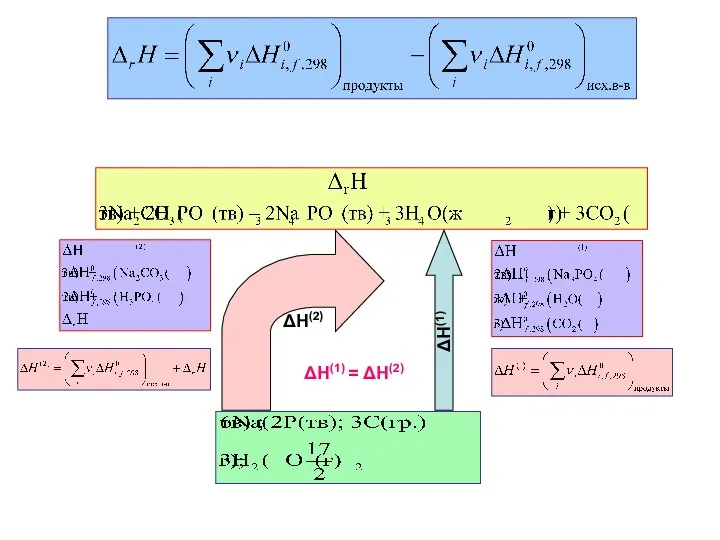
- 13. Следствия закона Гесса Тепловой эффект химической реакции равен разности суммы теплот образования (энтальпий образования) продуктов реакции
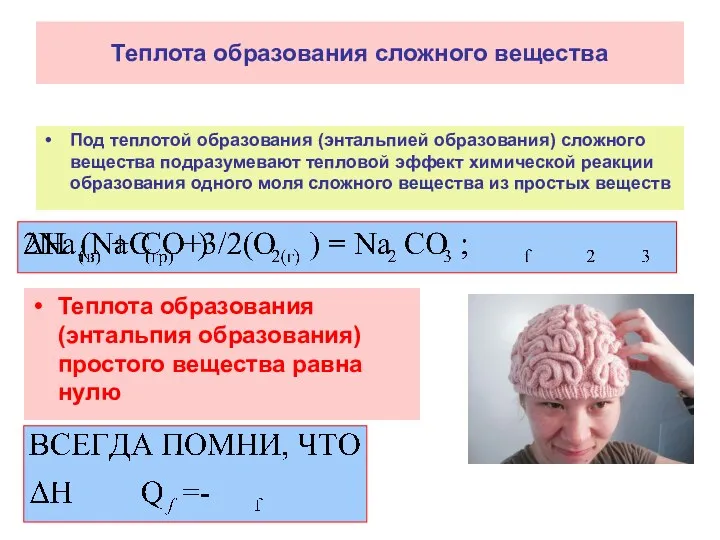
- 14. Теплота образования сложного вещества Под теплотой образования (энтальпией образования) сложного вещества подразумевают тепловой эффект химической реакции
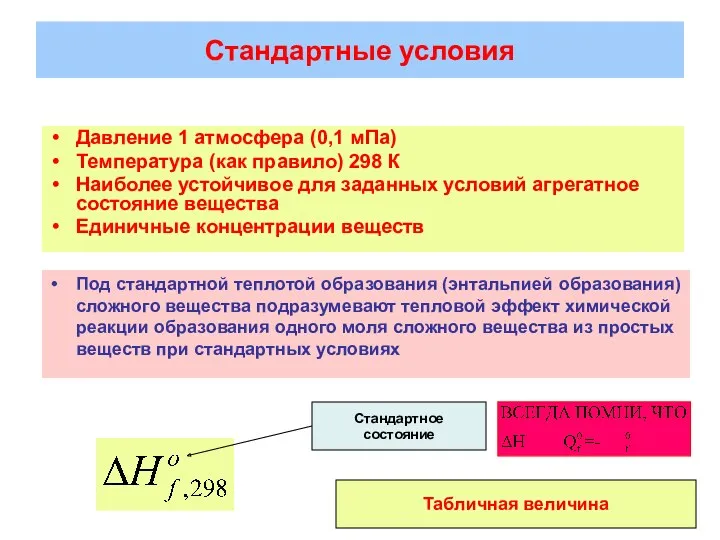
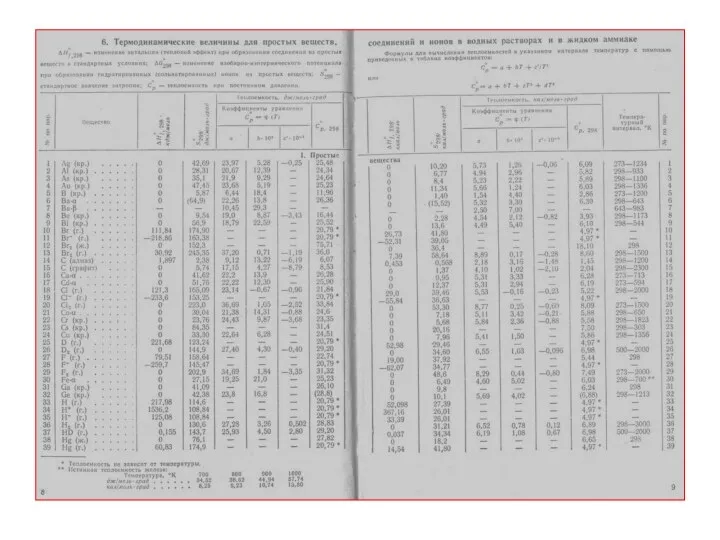
- 15. Стандартные условия Давление 1 атмосфера (0,1 мПа) Температура (как правило) 298 К Наиболее устойчивое для заданных
- 18. Абсолютные значения энтальпии не могут быть определены. Приняв в качестве «точки отсчета» теплоту образования простого вещества,
- 20. Типовые задачи
- 21. Задача Используя справочные данные, рассчитать тепловой эффект реакции обжига пирита. Записать термохимическое уравнение
- 22. Задача Тепловой эффект реакции равен Определить стандартную теплоту образования сероводорода, используя стандартные энтальпии образования оксида серы
- 23. Задача Какое количество карбоната кальция можно разложить, если затратить 510,3 кДж тепла?
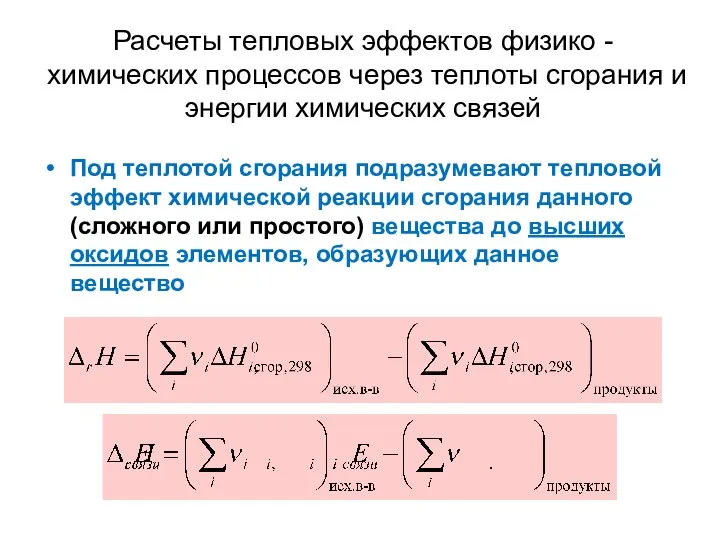
- 24. Расчеты тепловых эффектов физико -химических процессов через теплоты сгорания и энергии химических связей Под теплотой сгорания
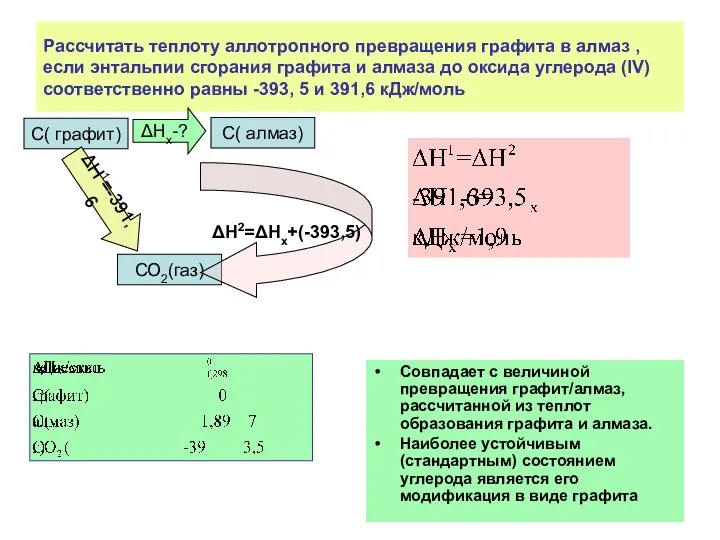
- 25. Рассчитать теплоту аллотропного превращения графита в алмаз , если энтальпии сгорания графита и алмаза до оксида
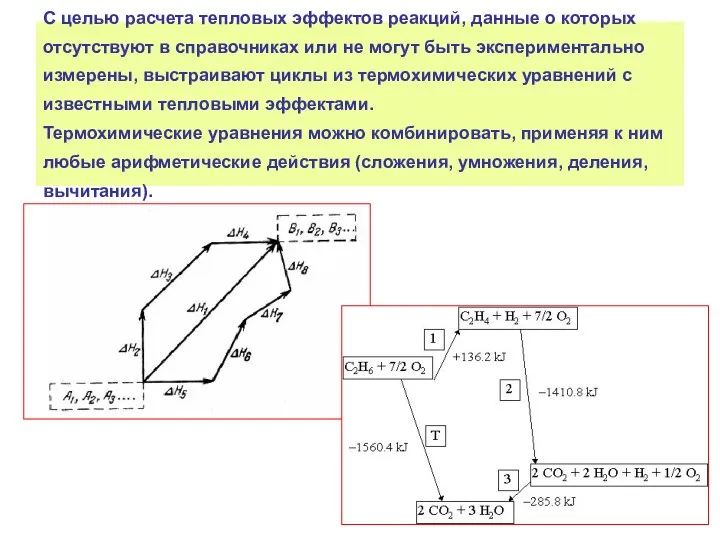
- 26. С целью расчета тепловых эффектов реакций, данные о которых отсутствуют в справочниках или не могут быть
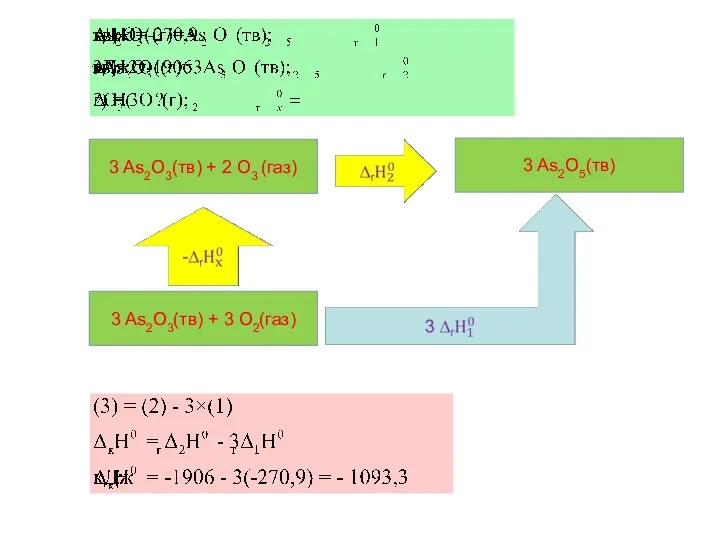
- 27. Задача Исходя из данных для реакций окисления оксида мышьяка (III) кислородом и озоном, написать термохимическое уравнение
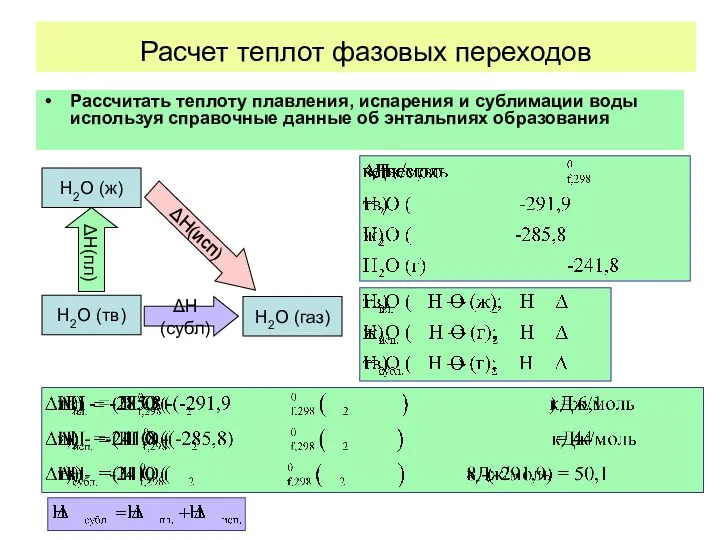
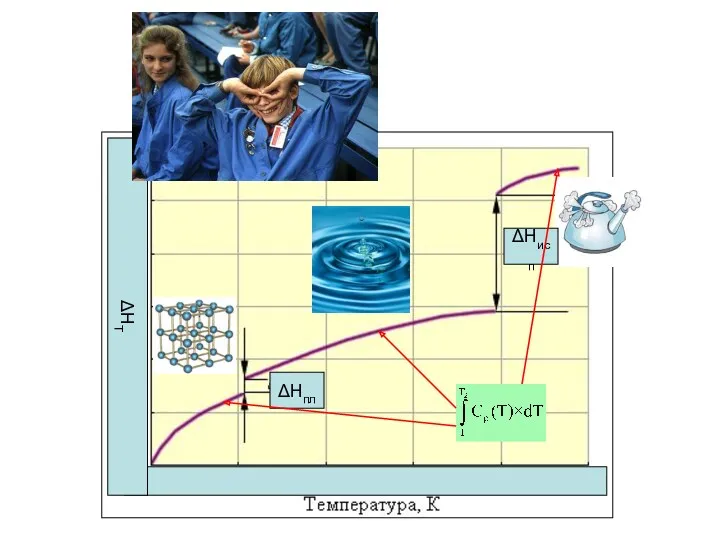
- 29. Расчет теплот фазовых переходов Рассчитать теплоту плавления, испарения и сублимации воды используя справочные данные об энтальпиях
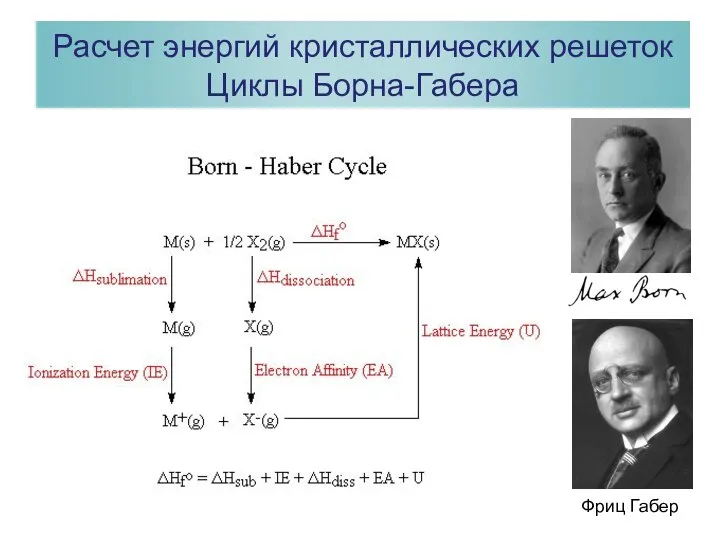
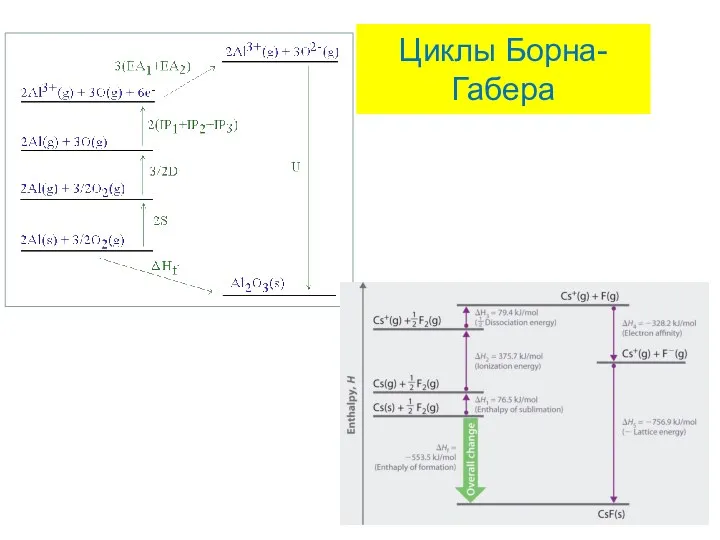
- 30. Расчет энергий кристаллических решеток Циклы Борна-Габера Фриц Габер
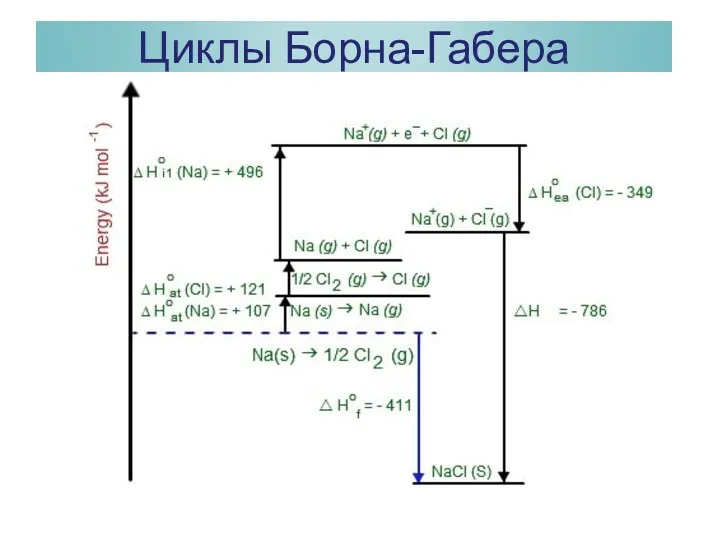
- 31. Циклы Борна-Габера
- 32. Циклы Борна-Габера
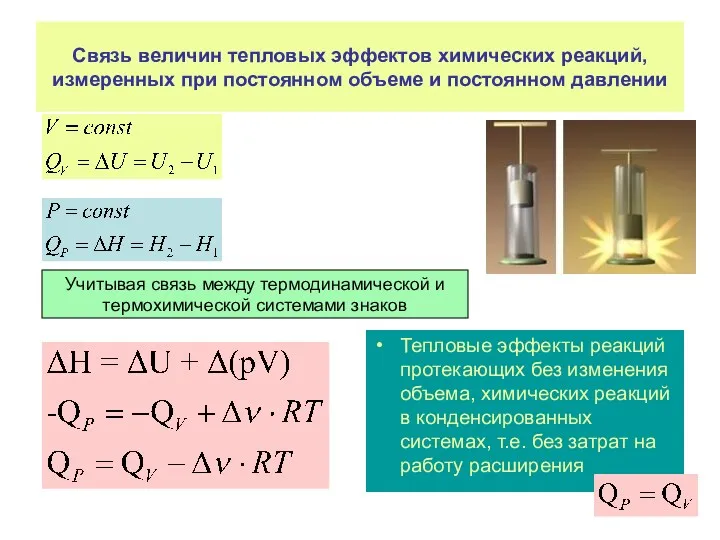
- 33. Связь величин тепловых эффектов химических реакций, измеренных при постоянном объеме и постоянном давлении Тепловые эффекты реакций
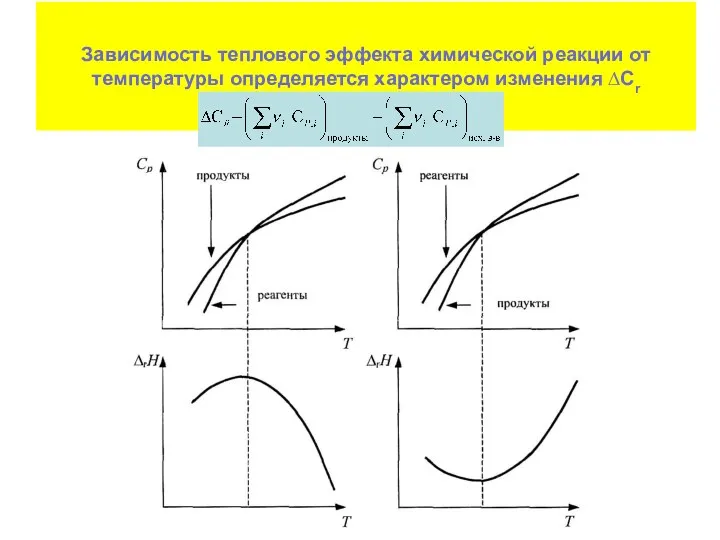
- 34. Температурная зависимость теплового эффекта химических реакций Закон Кирхгофа Температурный коэффициент теплового эффекта химической реакции равен изменению
- 36. Вывести аналитическую зависимость теплового эффекта (Дж) реакции от температуры
- 37. Зависимость теплового эффекта химической реакции от температуры определяется характером изменения ∆Сr
- 41. Скачать презентацию













 Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Органіка. Органічні речовини
Органіка. Органічні речовини Благородные газы
Благородные газы Растворы и свойства растворов. Лекция 3
Растворы и свойства растворов. Лекция 3 Типы химических реакций
Типы химических реакций Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Драгоценные камни
Драгоценные камни Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Объёмная доля компонента смеси
Объёмная доля компонента смеси Роль воды в химических реакциях
Роль воды в химических реакциях Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Предмет и задачи химии. Вещества и их свойства. (Продолжение)
Предмет и задачи химии. Вещества и их свойства. (Продолжение) Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Показатели жесткости воды
Показатели жесткости воды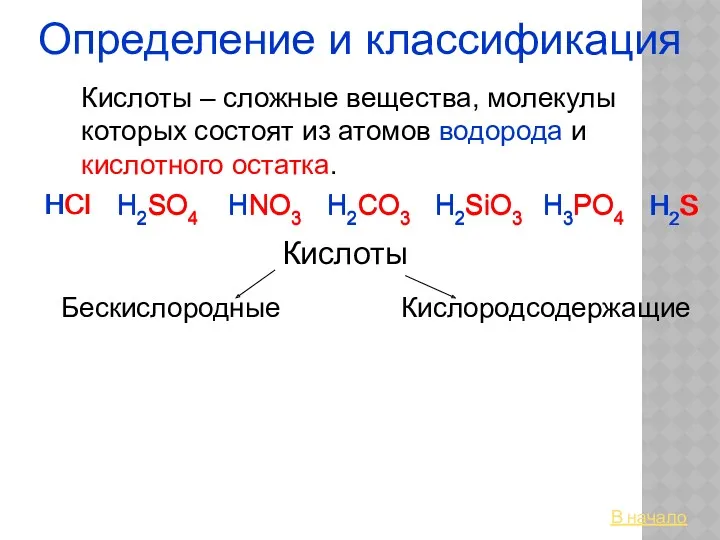 Кислоты. Определение и классификация
Кислоты. Определение и классификация Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием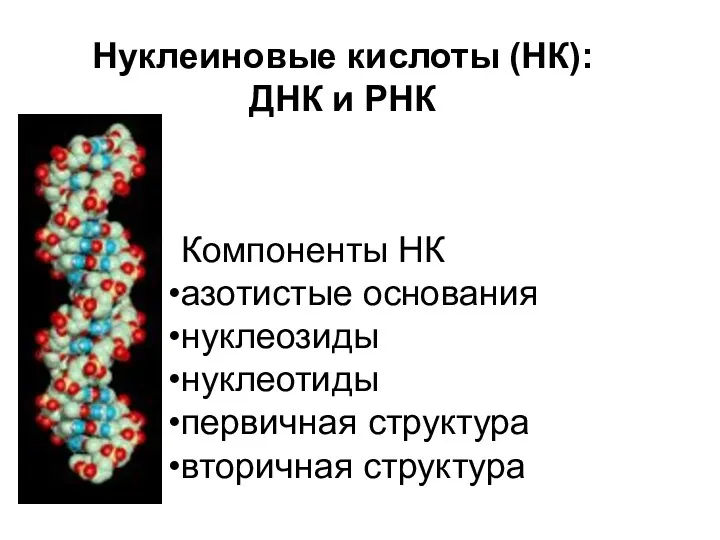 Нуклеиновые кислоты
Нуклеиновые кислоты Радиохимия
Радиохимия Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие