Содержание
- 2. Атом – сложная частица
- 3. Количественная характеристика растворов, растворение, растворимость
- 4. Растворы Растворы представляют собой гомогенные, или однородные, системы переменного состава, которые содержат два или несколько компонентов.
- 5. Растворы Раствор = Растворитель + Растворённое вещество Растворы Водные Неводные Водные растворы – это растворы, в
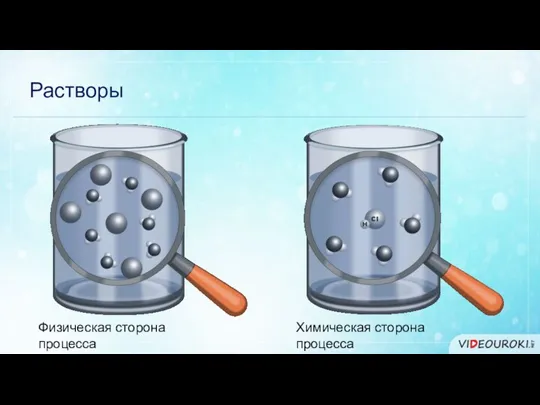
- 6. Растворы Физическая сторона процесса
- 7. Растворы Физическая сторона процесса Химическая сторона процесса
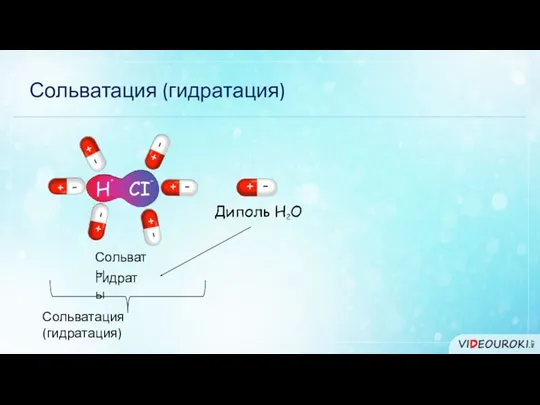
- 8. Сольватация (гидратация) Сольваты Гидраты Сольватация (гидратация)
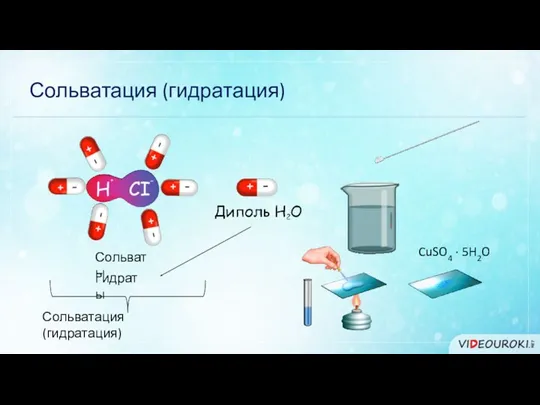
- 9. Сольватация (гидратация) Сольваты Гидраты Сольватация (гидратация) CuSO4 · 5H2O
- 10. Кристаллогидраты Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. CuSO4 · 5H2O Медный купорос Na2SO4 · 10H2O
- 11. Гидратная теория (1887 год) Д. И. Менделеев (1834–1907) «Растворы суть химические соединения, определяемые силами, действующими между
- 12. «Подобное растворяется в подобном…»
- 13. Растворение Уксусная кислота + вода Масло + вода
- 14. Растворение Q (растворения) = -Q (разрыв химических связей) + Q (образование химических связей) NaOH, H2SO4, AgNO3
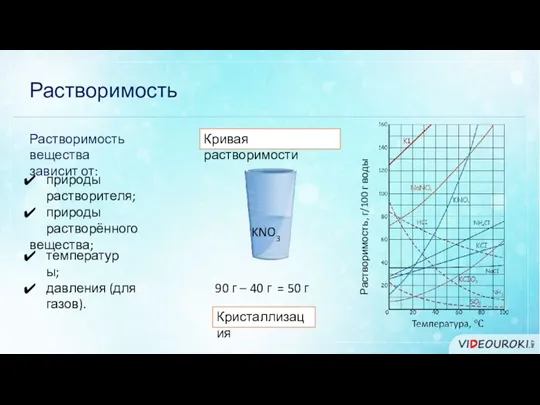
- 15. Растворы Насыщенный Ненасыщенный Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества
- 16. Растворимость Вещества по растворимости Хорошо растворимые Малорастворимые Практически нерастворимые Растворимость вещества больше 1 г на 100
- 17. Растворимость Растворимость вещества зависит от: природы растворителя; природы растворённого вещества; температуры; давления (для газов). Растворимость, г/100
- 18. Кристаллизация приводит к образованию минералов.
- 19. Кристаллизация имеет большое значение в процессах, протекающих в почве.
- 20. Растворы Разбавленный Концентрированный Массовая доля растворённого вещества где ω – массовая доля растворённого вещества; m (в-ва)
- 21. Массовая доля растворённого вещества Дано: m (р-ра) = 200 г m (в-ва) = 40 г ω
- 22. Молярная концентрация где С – молярная концентрация, моль/л; n – количество растворённого вещества, моль; V –
- 23. Молярная концентрация Дано: V (р-ра) = 4 л m (NaOH) = 1,6 г C (NaOH) –
- 24. Молярная концентрация С, моль/л Обозначение молярности Название раствора 1 0,5 0,1 0,01 0,001 1 М 0,5
- 25. Количественный состав растворов Дано: ρ (р-ра) = 1,15 г/мл ω (H2SO4) = 20 % Решение: Ответ:
- 26. Массовая концентрация (титр) Дано: ρ (р-ра) = 1,012 г/мл ω (HNO3) = 15 % Т (HNO3)
- 27. Состав и свойства растворов. Растворение и растворимость. Количественные характеристики состава растворов.
- 29. Скачать презентацию






















 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука