Содержание
- 2. Алюминий в природе. Алюминий – самый распространённый элемент в природе после кислорода и кремния. В свободном
- 3. Получение алюминия. В промышленности алюминий получают электролизом чистого Al2O3 или очищенного боксита в расплавленном криолите Na3(AlF6).
- 4. Для получения 1 тонны алюминия расходуется 2 тонны Al2O3, 60 кг криолита, около 20000 квт электроэнергии.
- 5. Атом алюминия на внешнем квантовом слое имеет три электрона, которые он отдаёт при химических превращениях. Металлический
- 6. Все эти соединения при взаимодействии с водой разлагаются (гидролизируются). Алюминий взаимодействует и со многими сложными веществами.
- 8. Скачать презентацию
Алюминий в природе.
Алюминий – самый распространённый элемент в природе после кислорода
Алюминий в природе.
Алюминий – самый распространённый элемент в природе после кислорода
Боксит – исходное сырьё для получения алюминия, он представляет собой гидратированный оксид алюминия Al2O3 * nH2O, загрязнённый оксидами железа, титана, кремния.
Получение алюминия.
В промышленности алюминий получают электролизом чистого Al2O3 или очищенного боксита
Получение алюминия.
В промышленности алюминий получают электролизом чистого Al2O3 или очищенного боксита
В электролитической ванне температура плавления достигает 950 – 1000 градусов по Цельсию. Кроме того криолит и другие добавки (CaF2) снижают плотность электролита.
Для получения 1 тонны алюминия расходуется 2 тонны Al2O3, 60 кг
Для получения 1 тонны алюминия расходуется 2 тонны Al2O3, 60 кг
Одним из главных достоинств алюминия является то, что его запасы практически неисчерпаемые. Он является экологически чистым металлом , не содержит примесей тяжёлых металлов, не выделяет вредные вещества под воздействием ультрафиолета. Алюминий – лёгкий, прочный, некоррозирующий металл, обладающий высокой устойчивостью к воздействию внешней среды. Долговечность алюминиевых конструкций – более 80 лет. В чистом виде алюминий – это мягкий, лёгкий, серебристо – белый металл с высокой тепло и электропроводностью. Алюминий и его сплавы делятся по способу получения на деформируемые, подвергаемые обработке давлением и литейные, используемые в виде фасонного литья.
Атом алюминия на внешнем квантовом слое имеет три электрона, которые он
Атом алюминия на внешнем квантовом слое имеет три электрона, которые он
Все эти соединения при взаимодействии с водой разлагаются (гидролизируются). Алюминий взаимодействует
Все эти соединения при взаимодействии с водой разлагаются (гидролизируются). Алюминий взаимодействует
Концентрированные кислоты на холоде пассивируют алюминий, образуя нерастворимый в кислотах оксид алюминия. В горячей серной кислоте алюминий растворяется:
2Al+6H2SO4=Al2(SO4)3+3SO2+6H2O.





 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Общая характеристика неметаллов
Общая характеристика неметаллов Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Вода – основа жизни на Земле
Вода – основа жизни на Земле Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Азот
Азот Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Соли. Названия солей
Соли. Названия солей Пиролиз углеводородов
Пиролиз углеводородов Минерал чароит. Месторождения
Минерал чароит. Месторождения Магний (Mg)
Магний (Mg) Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Углеводы (сахариды)
Углеводы (сахариды) α-Аминокислоты. Белки
α-Аминокислоты. Белки Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс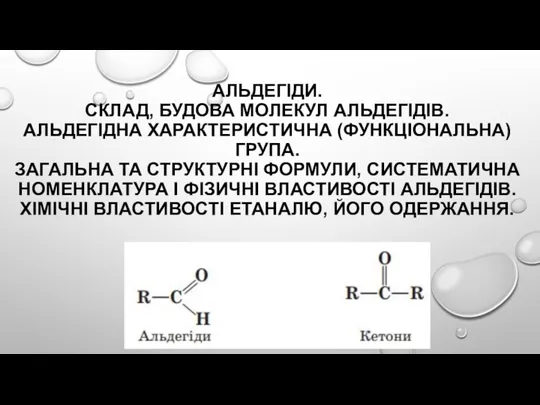 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Химические свойства солей
Химические свойства солей Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Соединения водорода
Соединения водорода Кристаллохимия негіздері
Кристаллохимия негіздері Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5)