Содержание
- 2. Родился Ле Шателье в Париже 8 октября 1850 года. Умер 17 сентября 1936. Отец Анри, горный
- 3. Ле Шателье был одним из первых химиков, систематически проводившим фундаментальные исследования металлургических и химико-технологических процессов. С
- 4. В 1884 В 1884 г. Ле Шателье сформулировал принцип динамического равновесия В 1884 г. Ле Шателье
- 5. НАУЧНАЯ ДЕЯТЕЛЬНОСТЬ При активном участии Ле Шателье физическая химия и химическая технология превратились в самостоятельные, активно
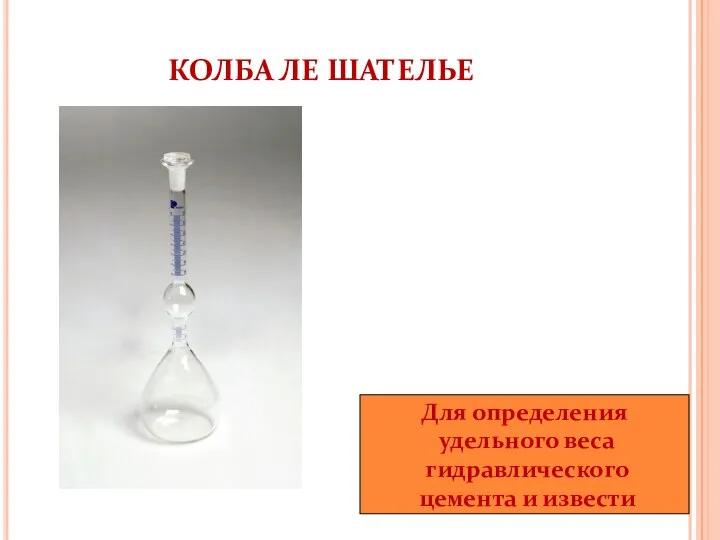
- 6. КОЛБА ЛЕ ШАТЕЛЬЕ Для определения удельного веса гидравлического цемента и извести
- 7. КОЛЬЦО ЛЕ ШАТЕЛЬЕ Для определения равномерности изменения объема цемента и гашеной извести.
- 8. 1881 Совместно с М. Бертло и Ф. Малларом он занялся исследованиям процессов воспламенения, горения и взрыва.
- 9. 1884 Сформулировал общий закон смещения химического равновесия в зависимости от внешних факторов: Внешнее воздействие, которое выводит
- 10. ПРИНЦИП ЛЕ ШАТЕЛЬЕ если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, температура, давление),
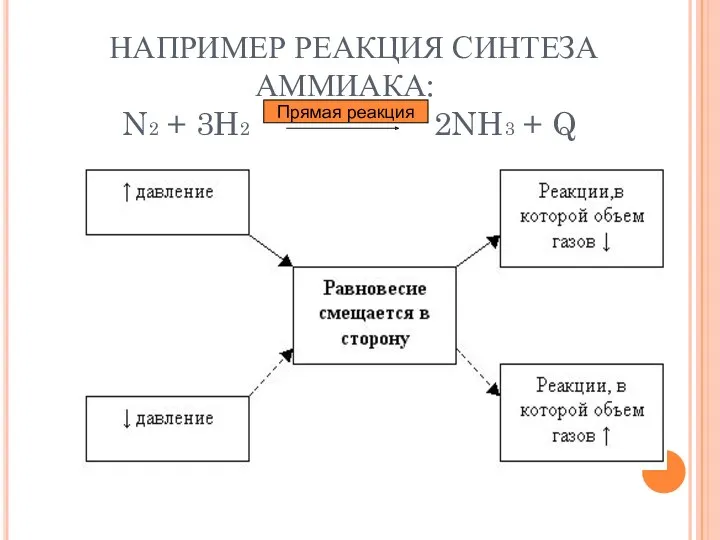
- 11. НАПРИМЕР РЕАКЦИЯ СИНТЕЗА АММИАКА: N2 + 3H2 2NH3 + Q Прямая реакция
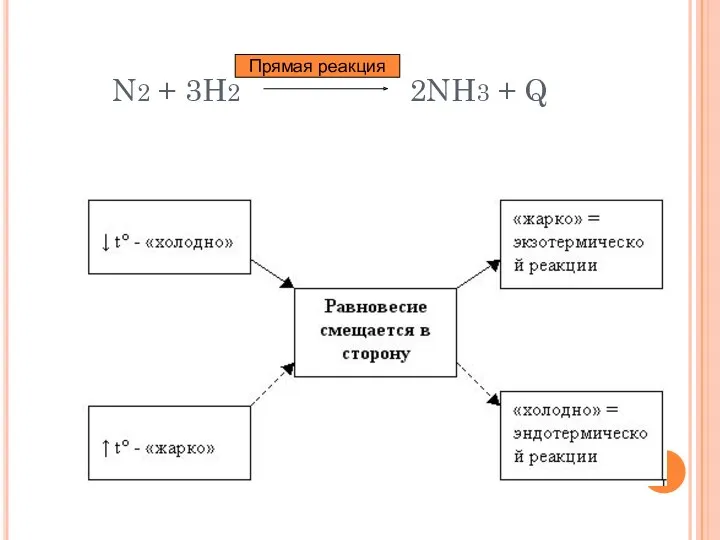
- 12. N2 + 3H2 2NH3 + Q Прямая реакция
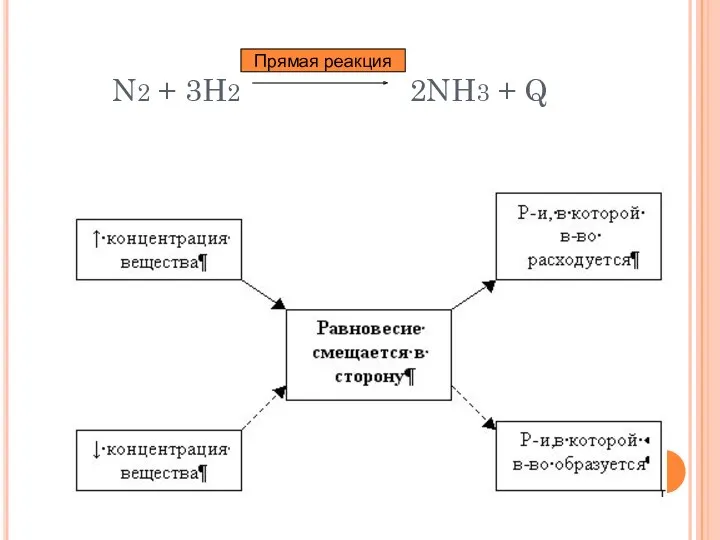
- 13. N2 + 3H2 2NH3 + Q Прямая реакция
- 14. ВЫВОДЫ: При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов; При повышении концентрации продуктов
- 15. 1886 Разработал пирометр – оптический прибор, измеряющий температуру раскалённых тел по их цвету. Усовершенствовал методику исследования
- 16. 1897 Создал металлографический микроскоп , с помощью которого можно было изучать строение непрозрачных объектов. СОВРЕМЕННЫЙ ПРИБОР
- 17. 1894 Вывел уравнение, устанавливающие зависимость между растворимостью, температурой процесса и теплотой плавления вещества. Независимо от Ф.
- 18. НАГРАДЫ: В 1886Г КАВАЛЕР ОРДЕНА ПОЧЁТНОГО ЛЕГИОНА 1916Г. МЕДАЛЬ ДЭВИ ЛОНДОНСКОГО КОРОЛЕВСКОГО ОБЩЕСТВА
- 20. Скачать презентацию












 Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Sources of alkanes and cycloalkanes. Crude oil
Sources of alkanes and cycloalkanes. Crude oil Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Механическая смесь и растворы
Механическая смесь и растворы Аминокислоты. Физические свойства
Аминокислоты. Физические свойства Химия. D-элементтер
Химия. D-элементтер Обмен нуклеотидов
Обмен нуклеотидов Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура
Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура Соли. Определение солей
Соли. Определение солей Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118 Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Классы неорганических веществ
Классы неорганических веществ Гетерофункциональные соединения
Гетерофункциональные соединения Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Галогены
Галогены Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Ізомери у природі
Ізомери у природі Жидкое и растворимое стекло
Жидкое и растворимое стекло Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки