Содержание
- 2. Коллоидная химия ‒ … … наука о поверхностных явлениях и дисперсных системах. … наука о коллоидном
- 4. Термин «коллоид» (от греч. kolla+eidos («клей» + «вид») слово, означающее «имеющие вид клея».) ввел английский ученый
- 5. Впоследствии было выяснено, что Грэм ошибался, следовало бы говорить не об особых веществах коллоидах, а об
- 6. Томас Грэм (20.12.1805, Глазго, 11.9.1869, Лондон), английский химик, В 1837 - 55 профессор Лондонского университетс-кого колледжа,
- 7. Коллоидная химия- наука о дисперсных системах и поверхностных явлениях, взаимосвязи физико-химических и механических свойств дисперсных систем.
- 9. Коллоидные растворы золота полученные Майклом Фарадеем
- 14. Основные понятия: Дисперсность ‒ мерой её служит удельная поверхность (Sуд). Sуд ‒ площадь раздела фаз, приходящаяся
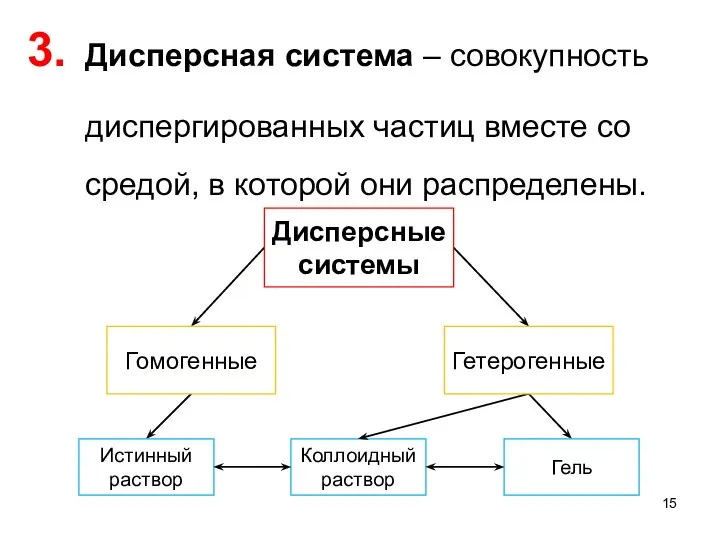
- 15. Дисперсная система ‒ совокупность диспергированных частиц вместе со средой, в которой они распределены. Дисперсные системы Гомогенные
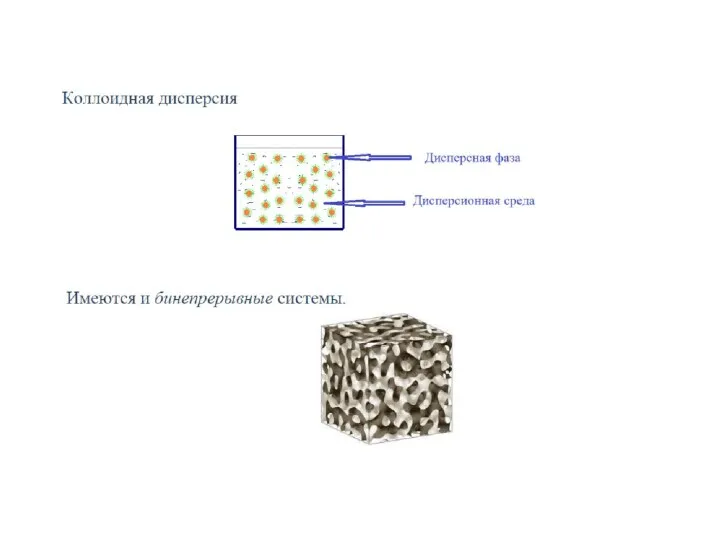
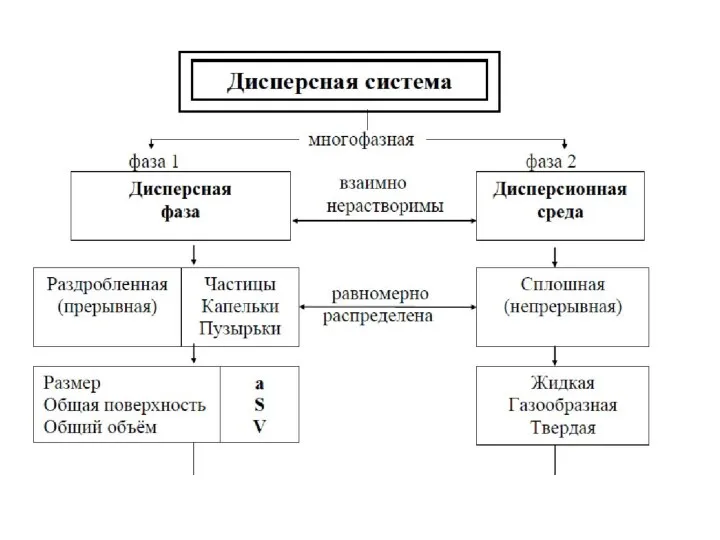
- 17. Дисперсная фаза (ДФ) ‒ совокупность диспергированных частиц, размеры которых больше молекулярных. Дисперсионная среда (ДС) ‒ однородная
- 19. Признаки объектов коллоидной химии
- 22. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц
- 23. Характерным признаком высокодисперсных систем является очень большая поверхность раздела на границе между дисперсной фазой и дисперсионной
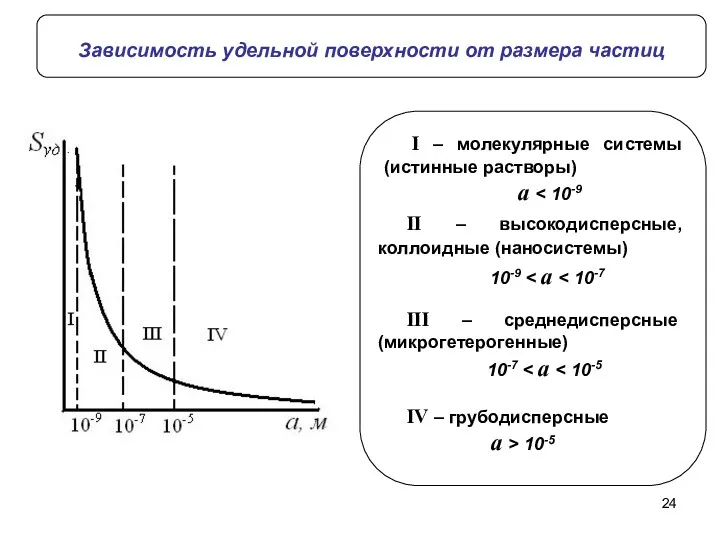
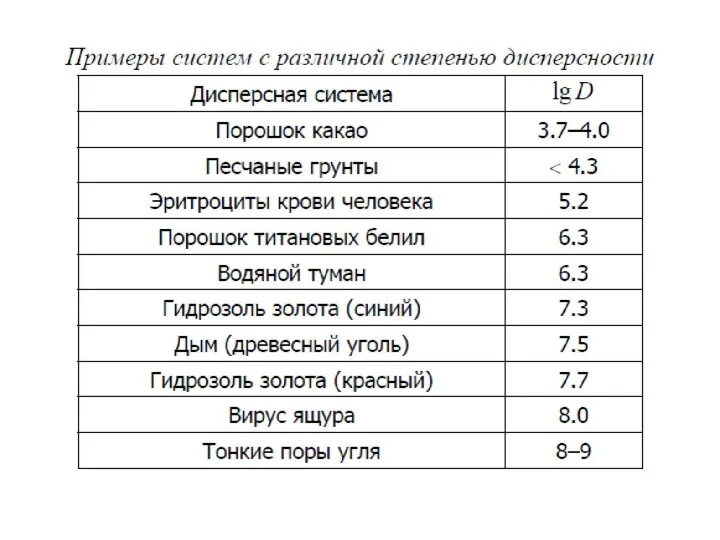
- 24. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
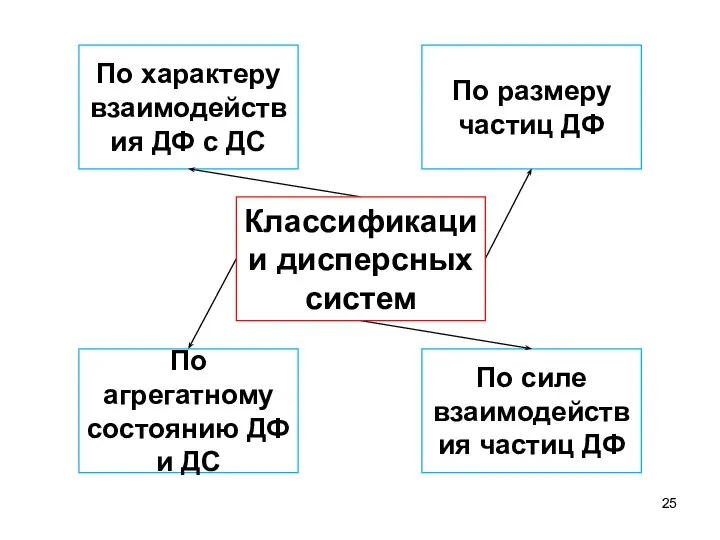
- 25. По размеру частиц ДФ По характеру взаимодействия ДФ с ДС По агрегатному состоянию ДФ и ДС
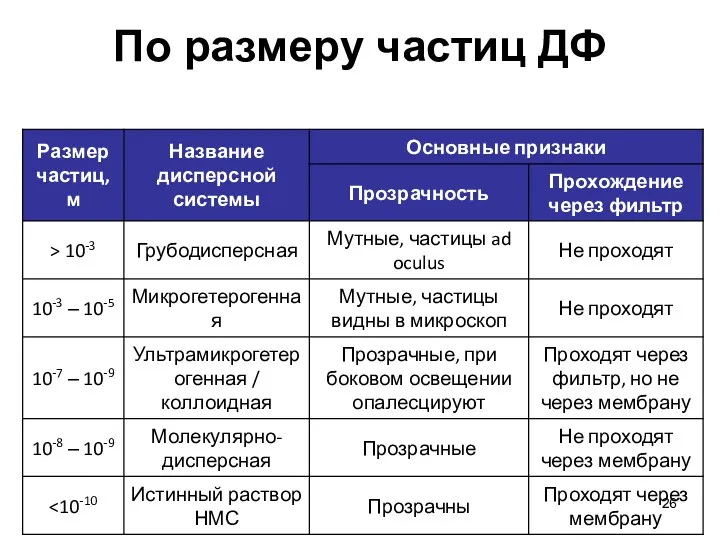
- 26. По размеру частиц ДФ
- 29. Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность
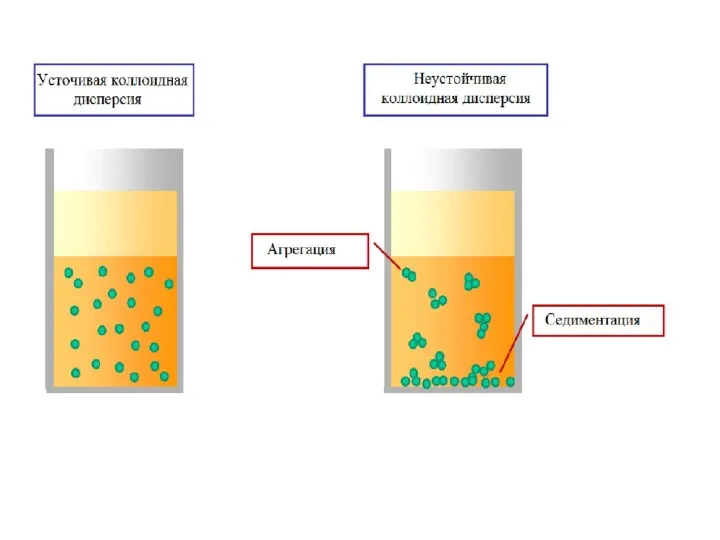
- 30. Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
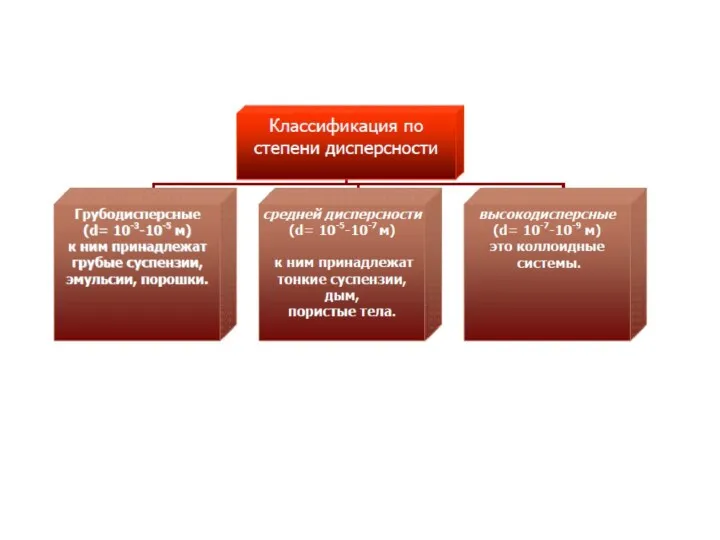
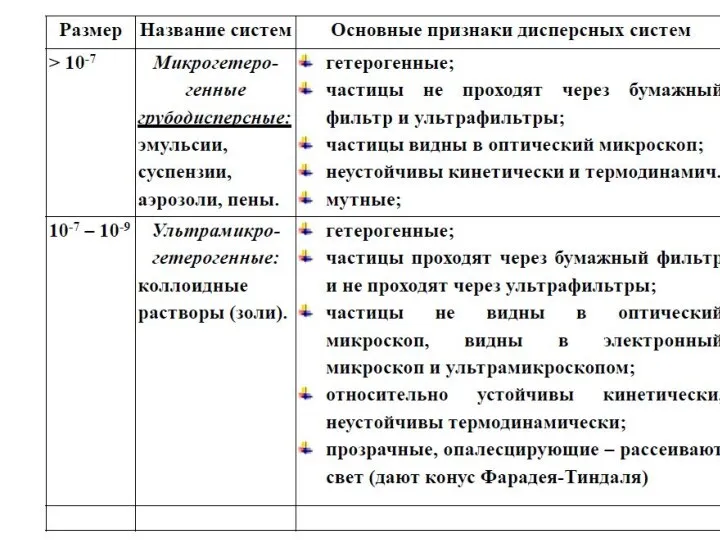
- 33. Классификация дисперсных систем по размерам частиц Дисперсность - отношение площади поверхности раздела к объему дисперсной фазы
- 34. Связнодисперсные системы классифицируют по размера пор. микропористые размеры пор менее 2 нм; переходнопористые 2 – 200
- 38. По характеру взаимодействия ДФ с ДС
- 39. Классификация дисперсных систем С) по термодинамической устойчивости (Г.Фрейндлих) Лиофильные коллоидные системы – высокодисперсные системы, образующиеся самопроизвольно
- 40. ФРЕЙНДЛИХ (Freundlich), Герберт Макс 1880 - 1941 Герберт Макс Фрейндлих – немецкий физико-химик. Родился в Берлине.
- 43. По силе взаимодействия частиц ДФ
- 45. В коллоидной химии под концентрацией чаще всего понимают число кинетических единиц (частиц) в единице объема (ν),
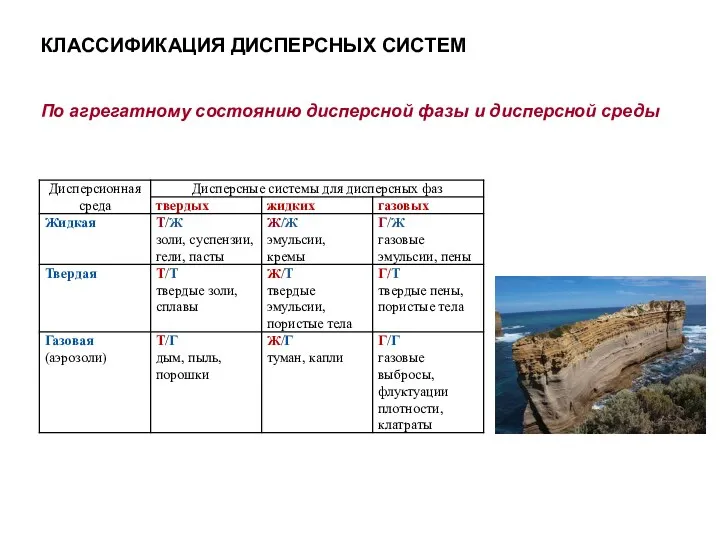
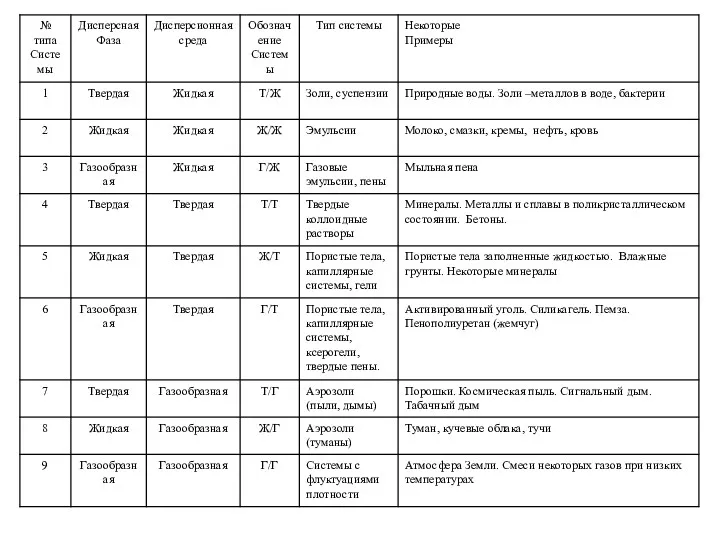
- 46. КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ По агрегатному состоянию дисперсной фазы и дисперсной среды
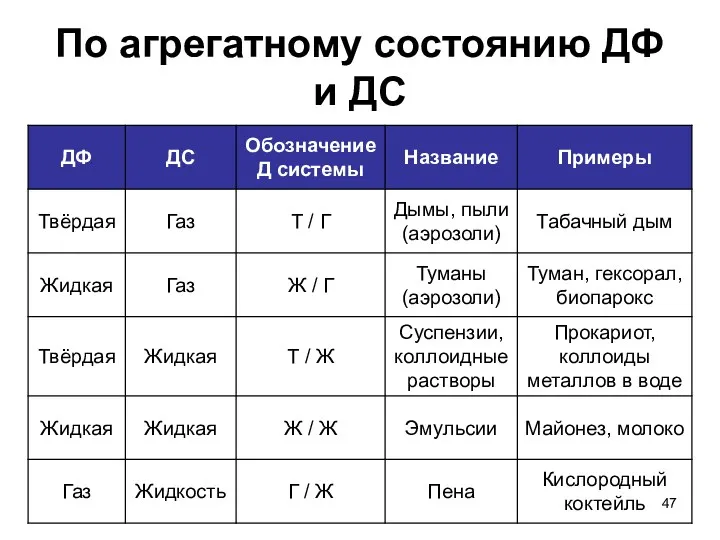
- 47. По агрегатному состоянию ДФ и ДС
- 49. Классификация дисперсных систем По топографическому признаку (по форме) Если минимальные размеры частиц каждой системы близки, то
- 50. Растворы полимеров – термодинамически равновесные с молекулярной дисперсностью. Свойства полимерных растворов зависят от молекулярной массы и
- 51. Фуллере́ны, бакибо́лы или букибо́лы — молекулярные соединения, принадлежащие классу аллотропных форм — молекулярные соединения, принадлежащие классу
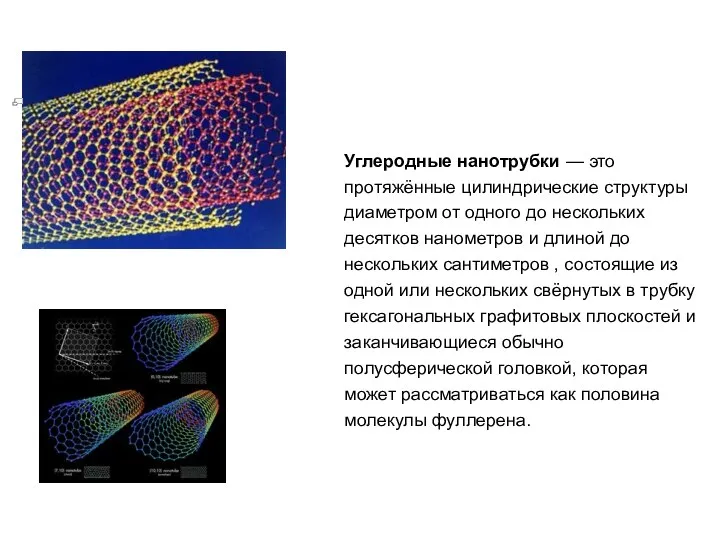
- 52. Углеродные нанотрубки — это протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной
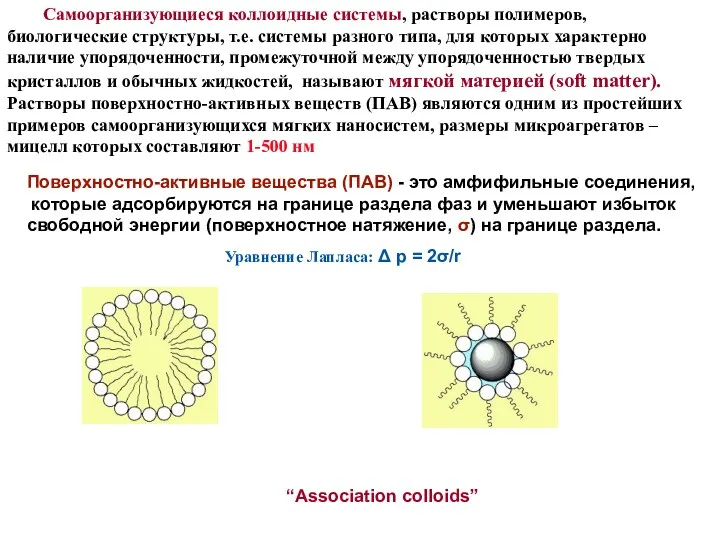
- 53. Самоорганизующиеся коллоидные системы, растворы полимеров, биологические структуры, т.е. системы разного типа, для которых характерно наличие упорядоченности,
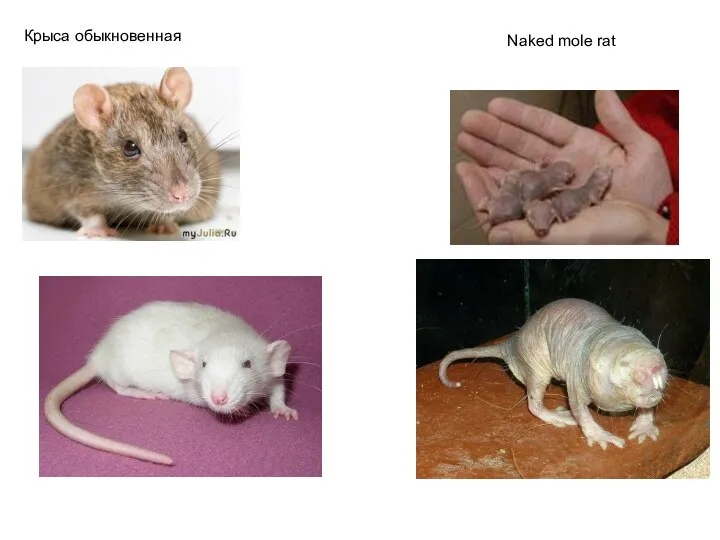
- 54. Крыса обыкновенная Naked mole rat
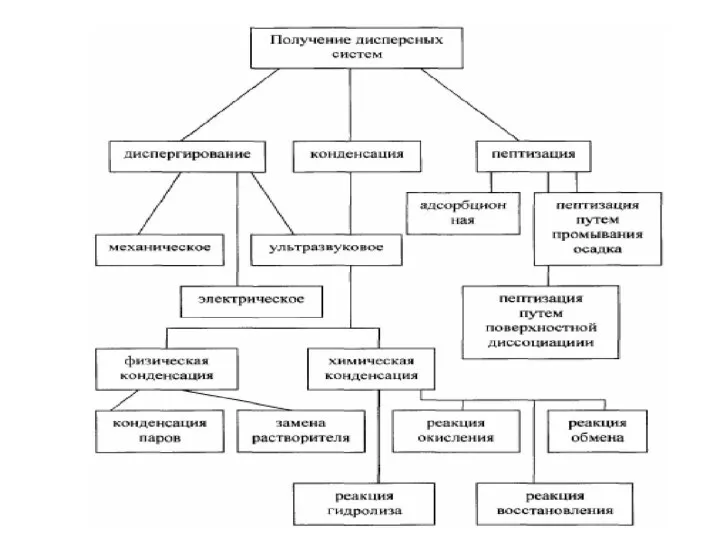
- 56. МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ В) Конденсация агрегация, концентрирование, кристаллизация физическая, химическая А) Диспергирование измельчение, дробление, распыление;
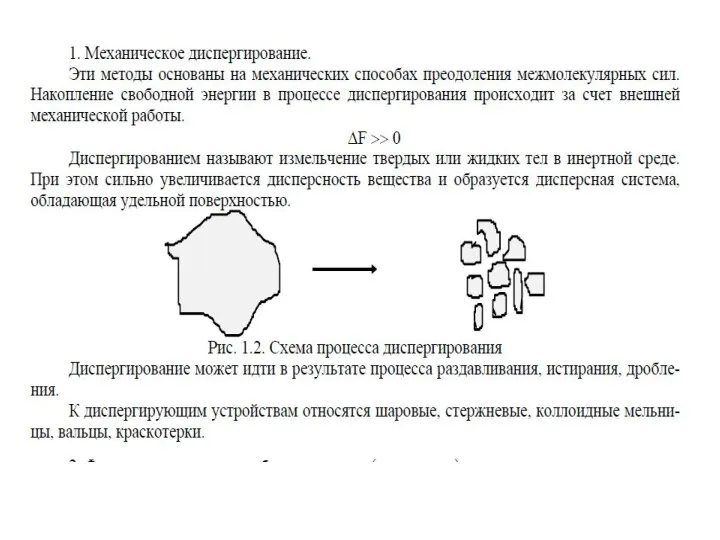
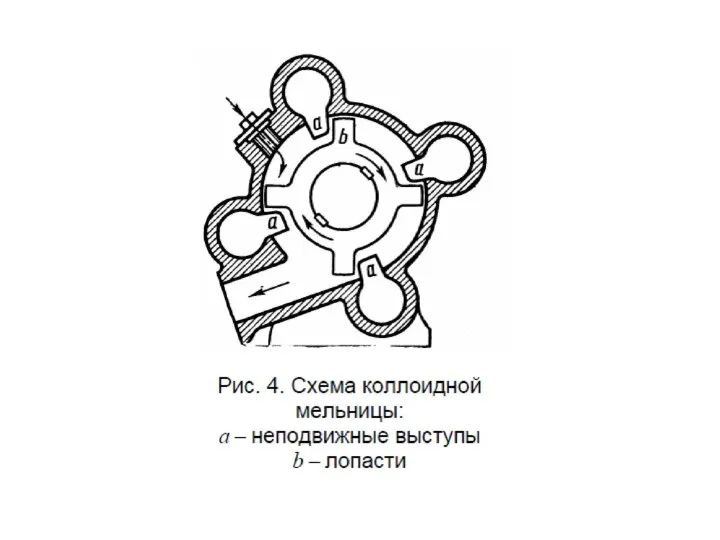
- 57. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 61. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 62. Физические конденсационные методы
- 63. Химические конденсационные методы
- 65. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 66. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 67. Метод пептизации
- 68. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 69. МЕТОДЫ ОЧИСТКИ ДИСПЕРСНЫХ СИСТЕМ Фильтрация – способ разделения, основанный на пропускании смеси через пористую пленку. Диализ
- 71. Скачать презентацию
















































 Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Сірке қышқылын алу технологиясы
Сірке қышқылын алу технологиясы Основы химической термодинамики
Основы химической термодинамики Выделение низших олефинов. Разделение непредельных газов
Выделение низших олефинов. Разделение непредельных газов Полимеры. Мономер
Полимеры. Мономер Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати Комплексонометрлік титрлеу
Комплексонометрлік титрлеу Стекло. Виды стекол
Стекло. Виды стекол Металлы
Металлы Жидкие кристаллы и их свойства
Жидкие кристаллы и их свойства Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Обмен липидов
Обмен липидов Аминокислоты. АТФ
Аминокислоты. АТФ Основные классы химических соединений
Основные классы химических соединений Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Химические реакции
Химические реакции Кислород. Атом кислорода
Кислород. Атом кислорода Геохимия литосферы
Геохимия литосферы Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Спекание. Основные типы спекания
Спекание. Основные типы спекания Соединения углерода
Соединения углерода Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Химические уравнения
Химические уравнения Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Электролитическая диссоциация
Электролитическая диссоциация