Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) презентация
Содержание
- 2. «Металлические» яды. Общая характеристика. Элементы группы «металлических» ядов: 1. Естественно содержащиеся в организме: Pb, Mn, Cr,
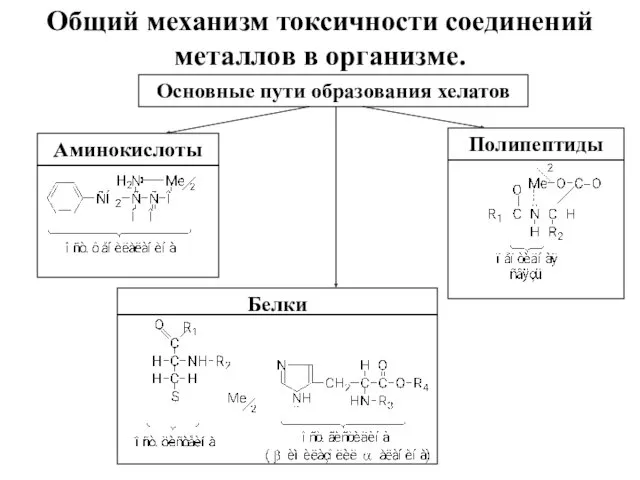
- 3. Общий механизм токсичности соединений металлов в организме. Основные пути образования хелатов Аминокислоты Полипептиды Белки
- 4. История развития методов минерализации. 1. А.П. Нелюбин [1816] – показал, что металлы в организме образуют прочные
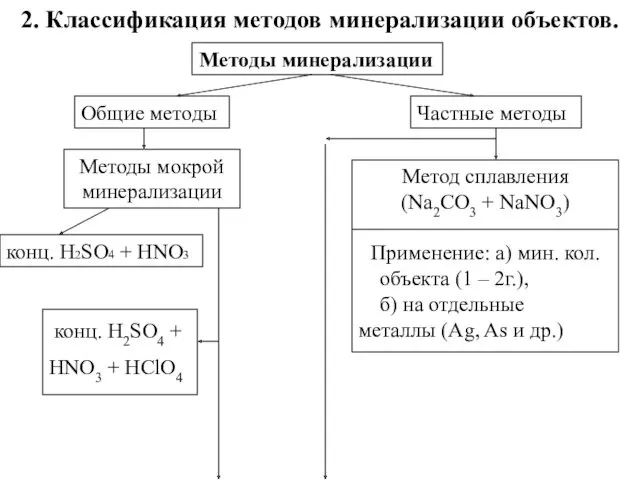
- 5. 2. Классификация методов минерализации объектов. Методы минерализации Общие методы Методы мокрой минерализации конц. H2SO4 + HNO3
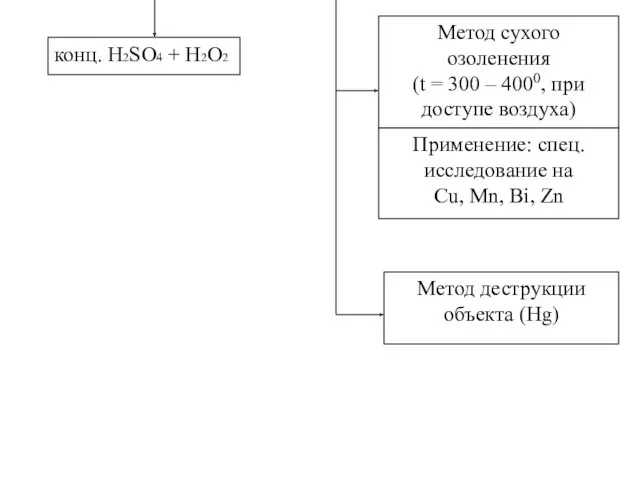
- 6. конц. H2SO4 + H2O2 Метод сухого озоленения (t = 300 – 4000, при доступе воздуха) Применение:
- 7. Достоинства метода к.H2SO4 и HNO3: 1. Быстрое достижение полноты разрушения органических компонентов; 2. Высокая чувствительность; 3.
- 8. Достоинства метода к.H2SO4, HNO3 и HClO4: 1. Полнота окисления органических веществ; 2.Окисление большинства поливалентных ионов до
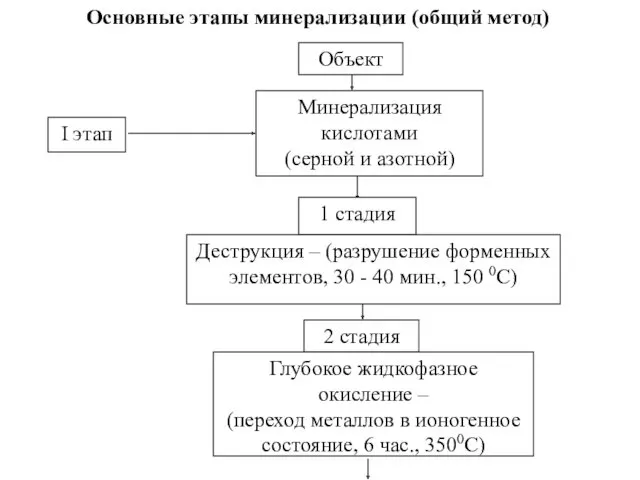
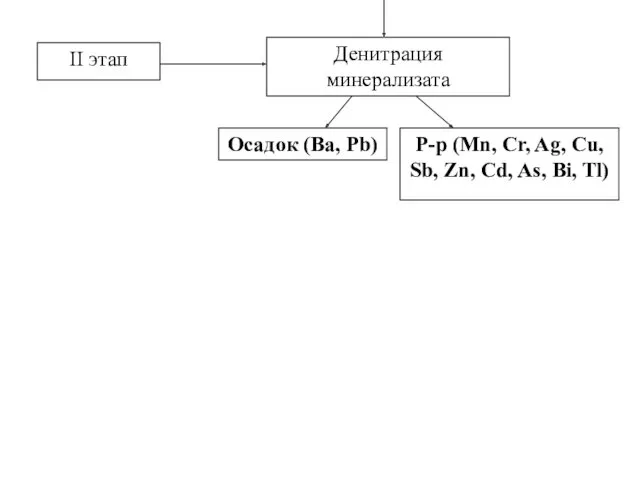
- 9. Основные этапы минерализации (общий метод) Объект Минерализация кислотами (серной и азотной) I этап 1 стадия Деструкция
- 10. Денитрация минерализата Р-р (Mn, Cr, Ag, Cu, Sb, Zn, Cd, As, Bi, Tl) Осадок (Ва, Рb)
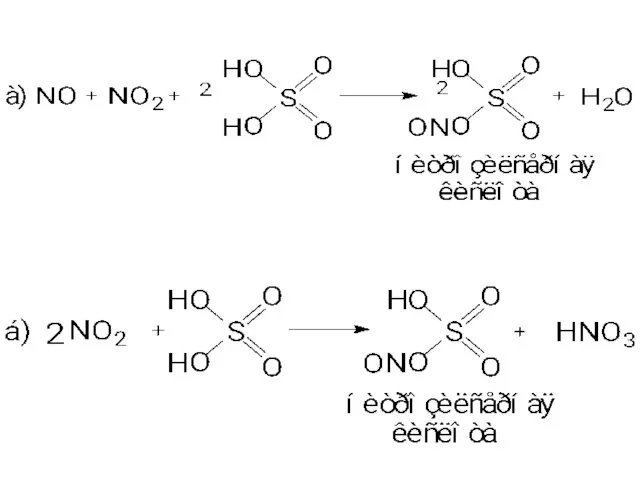
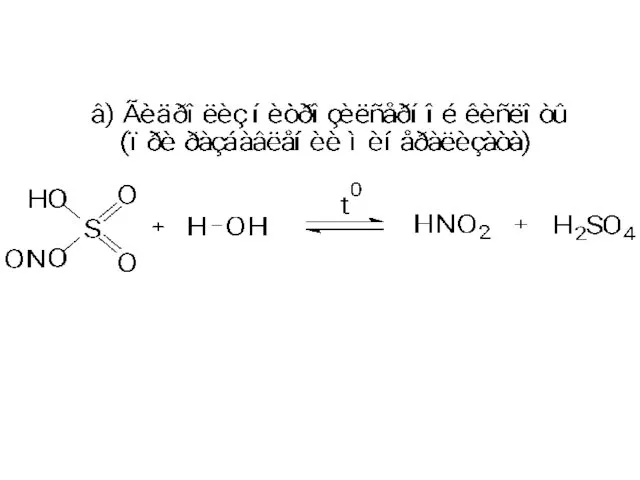
- 11. 3. Денитрация минерализата. Окислители и источники окислителей: изб. HNO3; HNO2; NO; NO2; нитрозилсерная кислота
- 14. В качестве восстановителей используются: - сульфит натрия; - мочевина; - формальдегид.
- 15. Денитрация минерализата формальдегидом: 4 HNO3 + 3 CH2O = 3 CO2 ↑ + 4 NO ↑
- 17. Скачать презентацию

![История развития методов минерализации. 1. А.П. Нелюбин [1816] – показал,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/113878/slide-3.jpg)





 Хімічні властивості кислот
Хімічні властивості кислот Радикальные реакции. (Лекция 9)
Радикальные реакции. (Лекция 9) Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Почему нефть называют черным золотом
Почему нефть называют черным золотом Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Производство водорода
Производство водорода Общие свойства металлов
Общие свойства металлов Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Минералы и горные породы
Минералы и горные породы Enantioselective Total Synthesis
Enantioselective Total Synthesis Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций Общая характеристика галогенов
Общая характеристика галогенов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Термодинамика химических процессов
Термодинамика химических процессов Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Свойства воды. Оценка качества
Свойства воды. Оценка качества Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Группа галогенов в периодической системе
Группа галогенов в периодической системе Подгруппа азота
Подгруппа азота Липиды. Классификация
Липиды. Классификация Химический элемент титан
Химический элемент титан Металлы в природе. Получение
Металлы в природе. Получение Кислоты. Состав кислот
Кислоты. Состав кислот Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Гетерофункциональные соединения
Гетерофункциональные соединения