Содержание
- 2. ИЗУЧИВ ЭТУ ТЕМУ, ВЫ БУДЕТЕ ЗНАТЬ: 1.СТРОЕНИЕ, СВОЙСТВА, КЛАССИФИКАЦИЮ ЭЛЕМЕНТОВ ПОДГРУППЫ АЗОТА 2.ФИЗИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ ПОДГРУППЫ
- 3. СОДЕРЖАНИЕ УЧЕБНОГО ЗАНЯТИЯ 1.ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ АЗОТА 2. СТРОЕНИЕ АТОМОВ 3.ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ 4.ХИМИЧЕСКИЕ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ АЗОТА Подгруппа азота занимает пятую группу (главную подгруппу) в таблице Дмитрия Ивановича Менделеева.
- 5. ХИМИЧЕСКИЕ СВОЙСТВА. 1. При высоких температурах азот реагирует с активными металлами: 3Mg + N2 → Mg3N2
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТ N2 При обычных условиях газ без цвета и запаха немного легче воздуха встречается
- 7. СПОСОБЫ ПОЛУЧЕНИЯ. В промышленности получают ректификацией воздуха В лаборатории – окислением аммиака (1), реакциями внутримолекулярного окисления-восстановления
- 8. ПРИМЕНЕНИЕ. Основное применение в качестве исходного вещества для получения аммиака; он широко используется для создания инертной
- 9. ПРИМЕНЕНИЕ. ЖИДКИЙ АЗОТ используют для охлаждения различного оборудования и техники; для охлаждения компонентов компьютера при экстремальном
- 10. ТЕСТ. ЧАСТЬ А Наибольшее число электронов на внешнем уровне: а) азот б) кислород в) водород г)
- 11. ЧАСТЬ А Концентрированная азотная кислота при обычных условиях пассивирует: а) железо б) кальций в) медь г)
- 12. ЧАСТЬ В Расставить коэффициенты методом электронного баланса: Ca + HNO3 Ca(NO3)2 + N2O + H2O Осуществить
- 13. РЕФЛЕКСИЯ: что понравилось на уроке? что было непонятно? что было сложным? Сегодня я узнал... Сегодня я
- 15. Скачать презентацию












 Процессы алкилирования
Процессы алкилирования Растворы
Растворы Серная кислота
Серная кислота Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция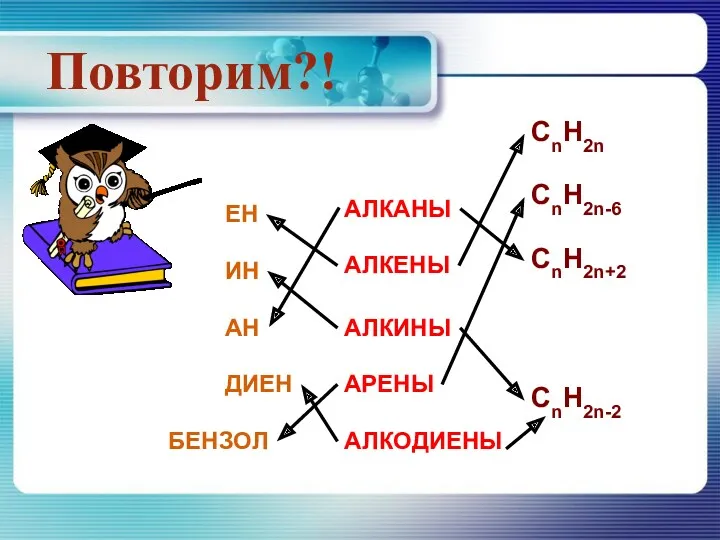 Органические вещества: производные углеводородов
Органические вещества: производные углеводородов Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Дисахариди. Амінокислоти. Пептиди
Дисахариди. Амінокислоти. Пептиди Валентность и степень окисления элементов
Валентность и степень окисления элементов Выращивание кристаллов
Выращивание кристаллов яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Гидролиз неорганических солей
Гидролиз неорганических солей Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Природные источники углеводородов
Природные источники углеводородов Минералы группы кварца
Минералы группы кварца Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Арены. Бензол
Арены. Бензол Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы 20230306_gidroliz
20230306_gidroliz Углекислый газ
Углекислый газ