Содержание
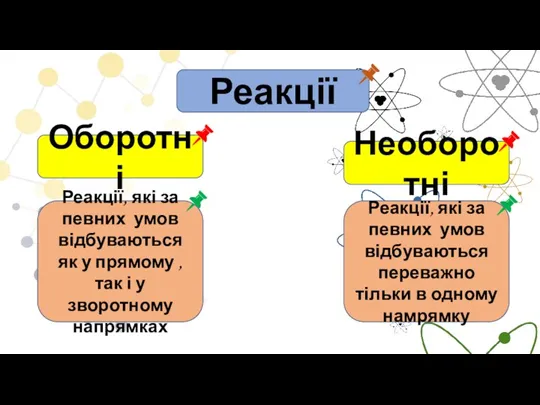
- 2. Реакції Оборотні Необоротні Реакції, які за певних умов відбуваються як у прямому , так і у
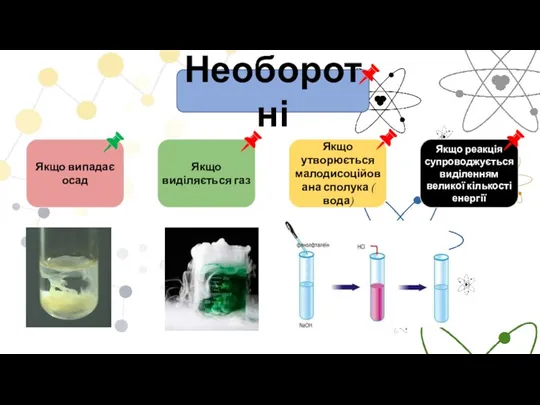
- 3. Необоротні
- 4. Установіть відповідність між явищем, що свідчить про перебіг хімічної реакції та її реагентами
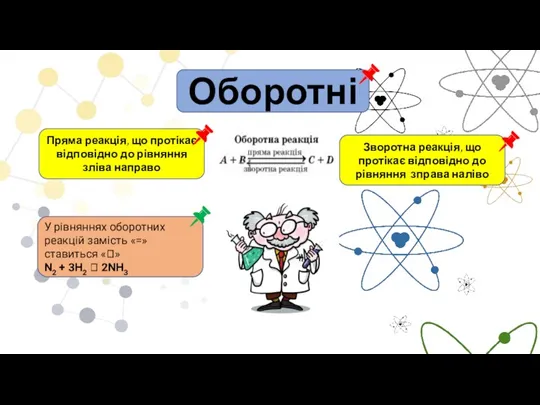
- 5. Оборотні Пряма реакція, що протікає відповідно до рівняння зліва направо У рівняннях оборотних реакцій замість «=»
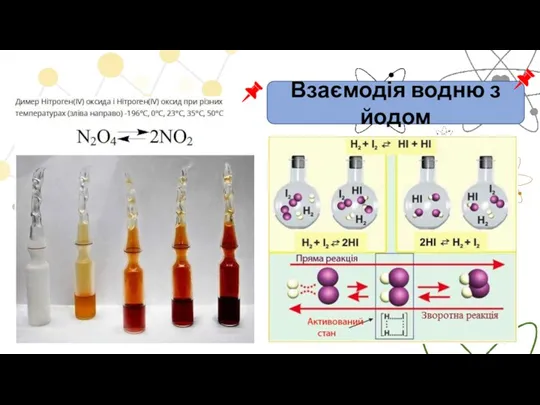
- 6. Взаємодія водню з йодом
- 7. Оборотні реакції в природі Під час грози температура в зоні електричного розряду становить 2000 °С, унаслідок
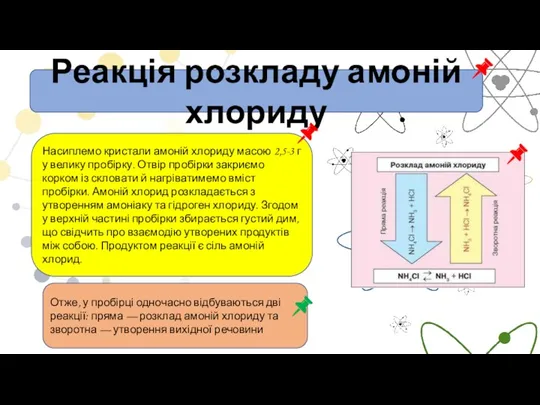
- 8. Реакція розкладу амоній хлориду Насиплемо кристали амоній хлориду масою 2,5-3 г у велику пробірку. Отвір пробірки
- 9. Історія Поняття оборотної реакції уведене у 1803 році Клодом Бертолле, після того як він спостерігав як
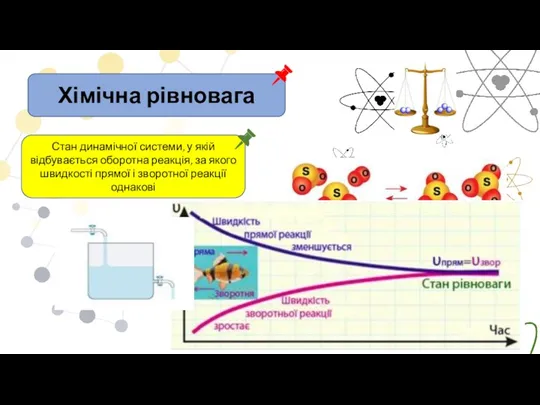
- 10. Хімічна рівновага Стан динамічної системи, у якій відбувається оборотна реакція, за якого швидкості прямої і зворотної
- 11. Принцип зміщення хімічної рівноваги Анрі Ле Шательє Якщо на рівноважну систему впливати ззовні, змінюючи будь-яку умову
- 12. Принцип Ле Шательє N2 + 3H2 ↔ 2NH3
- 13. Принцип Ле Шательє N2 + 3H2 ↔ 2NH3+Q
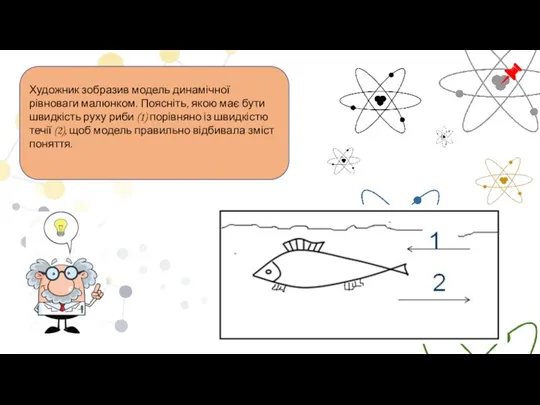
- 14. Художник зобразив модель динамічної рівноваги малюнком. Поясніть, якою має бути швидкість руху риби (1) порівняно із
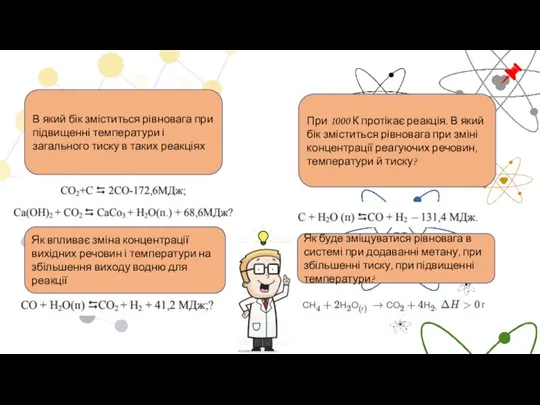
- 15. В який бік зміститься рівновага при підвищенні температури і загального тиску в таких реакціях Як впливає
- 16. В який бік зміститься рівновага при збільшенні тиску в таких реакціях В який бік зміститься рівновага
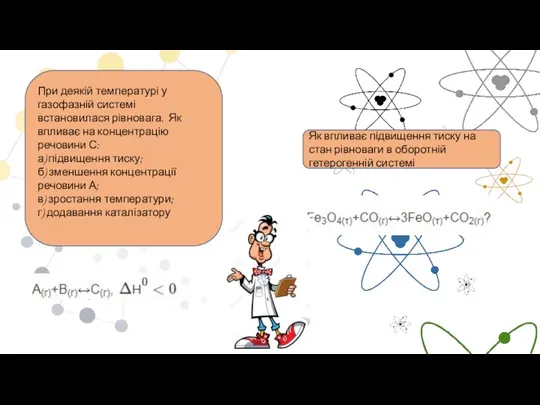
- 17. При деякій температурі у газофазній системі встановилася рівновага. Як впливає на концентрацію речовини С: а) підвищення
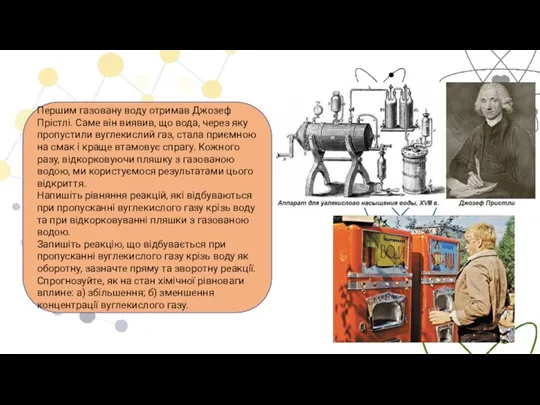
- 18. Першим газовану воду отримав Джозеф Прістлі. Саме він виявив, що вода, через яку пропустили вуглекислий газ,
- 19. Як відомо, чадний газ є небезпечним забруднювачем атмосфери, також це отрута, яка утворюється під час неповного
- 20. Нітроген (ІV) оксид є шкідливим побічним продуктом металургійних та хімічних підприємств, і часто влітку можна побачити,
- 22. Скачать презентацию









 Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Йонний, металічний, водневий хімічні зв’язки
Йонний, металічний, водневий хімічні зв’язки Текстуры и структуры метаморфических горных пород
Текстуры и структуры метаморфических горных пород Металл серебро
Металл серебро Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Водород H2
Водород H2 Химические свойста воды
Химические свойста воды Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation Железо и его соединения
Железо и его соединения Такой разный песок
Такой разный песок Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Синтез и химические модификации индиго
Синтез и химические модификации индиго Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау
Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау Amino acid and protein metabolism II
Amino acid and protein metabolism II Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Алюминий и его соединения
Алюминий и его соединения Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 Значение металлов для человека
Значение металлов для человека Карбонові кислоти
Карбонові кислоти Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода