Содержание
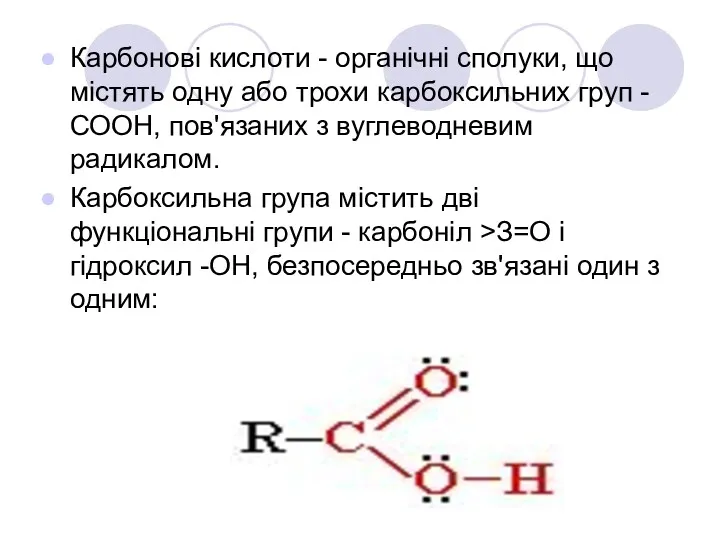
- 2. Карбонові кислоти - органічні сполуки, що містять одну або трохи карбоксильних груп -СООН, пов'язаних з вуглеводневим
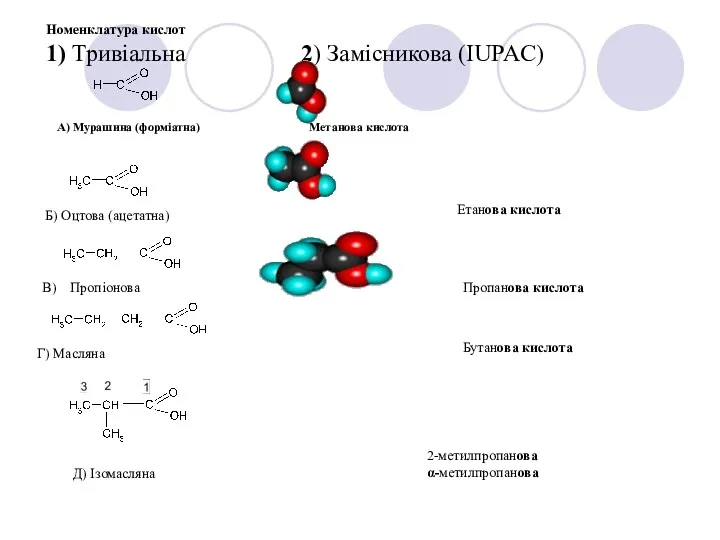
- 3. Номенклатура карбонових кислот Систематичні назви кислот даються за назвою відповідного вуглеводню з додаванням суфікса –ова й
- 4. Номенклатура кислот 1) Тривіальна 2) Замісникова (IUPAC) А) Мурашина (форміатна) Метанова кислота В) Пропіонова Б) Оцтова
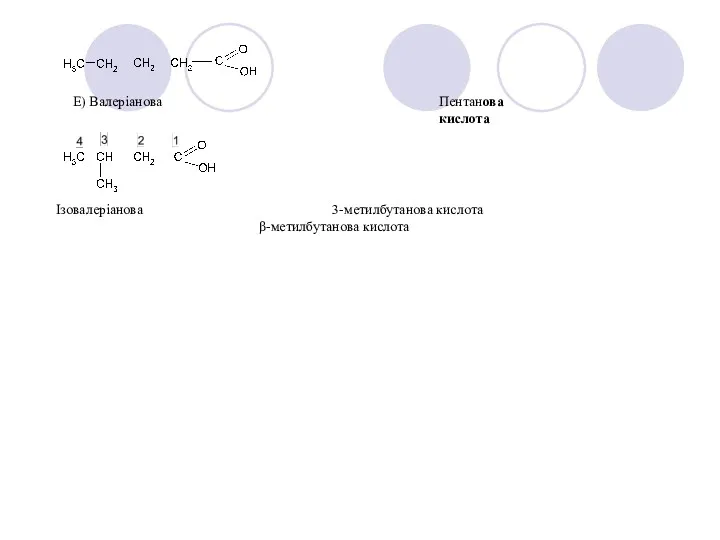
- 5. Е) Валеріанова Пентанова кислота Ізовалеріанова 3-метилбутанова кислота β-метилбутанова кислота
- 6. Класифікація карбонових кислот Карбонові кислоти класифікують по двох структурних ознаках. По числу карбоксильних груп кислоти поділяються
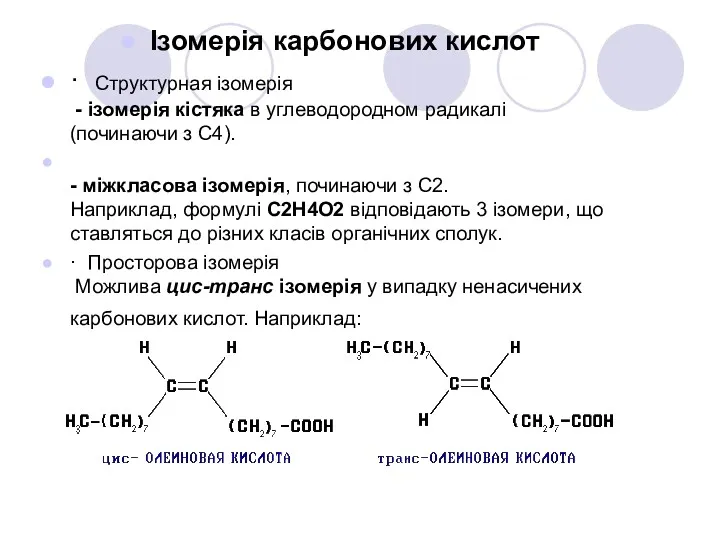
- 7. Ізомерія карбонових кислот · Cтруктурная ізомерія - ізомерія кістяка в углеводородном радикалі (починаючи з C4). -
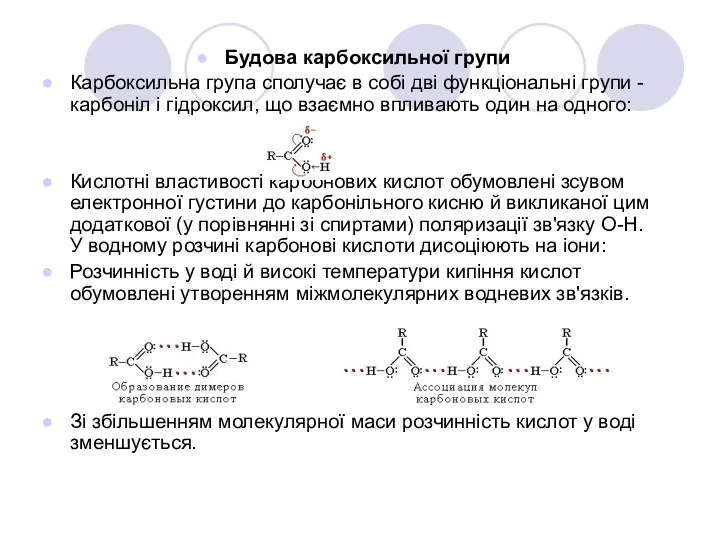
- 8. Будова карбоксильної групи Карбоксильна група сполучає в собі дві функціональні групи - карбоніл і гідроксил, що
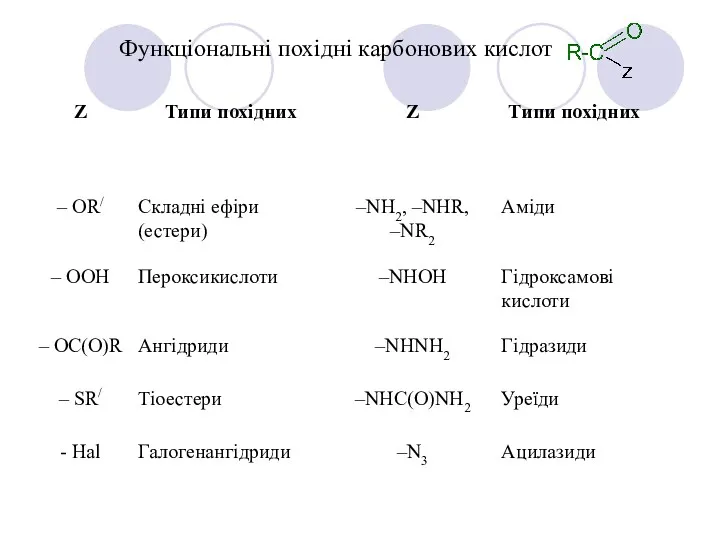
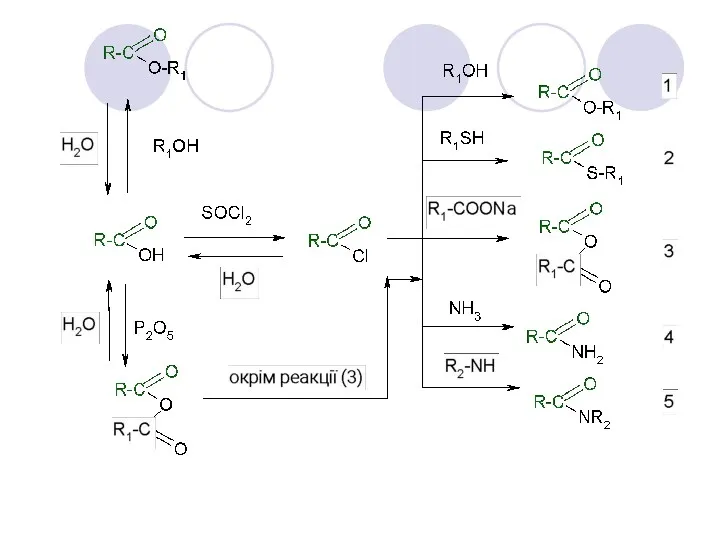
- 9. Функціональні похідні карбонових кислот Карбонові кислоти проявляють високу реакційну здатність. Вони вступають у реакції з різними
- 10. Функціональні похідні карбонових кислот
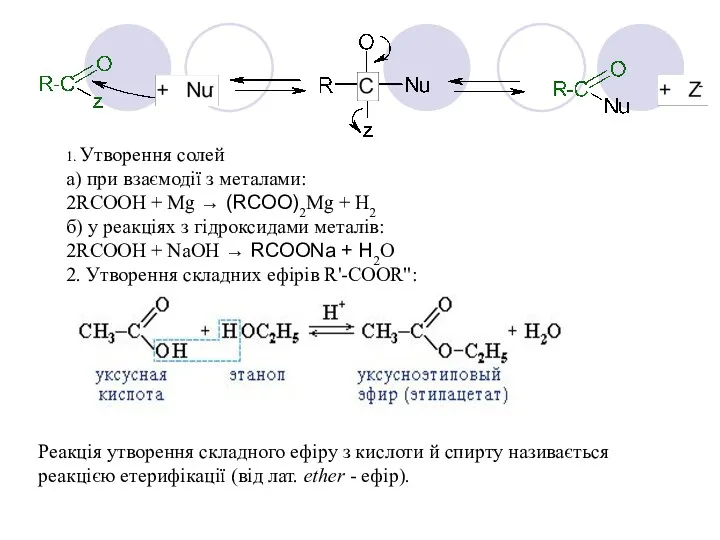
- 11. 1. Утворення солей а) при взаємодії з металами: 2RCOOH + Mg → (RCOO)2Mg + H2 б)
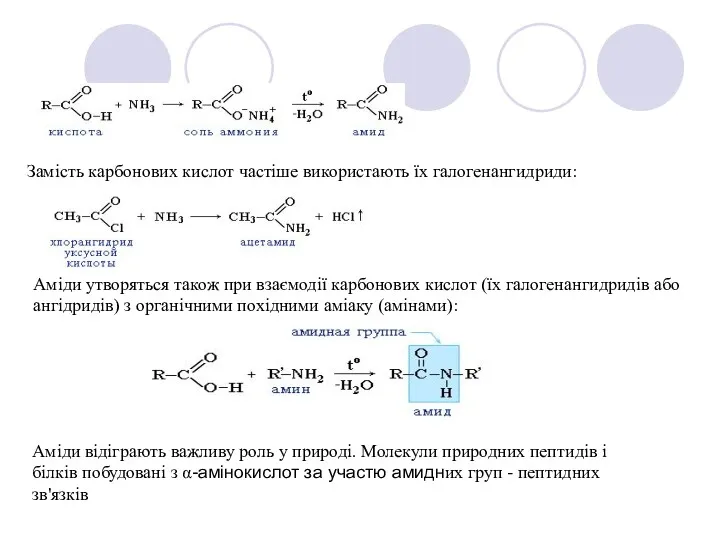
- 12. Замість карбонових кислот частіше використають їх галогенангидриди: Аміди утворяться також при взаємодії карбонових кислот (їх галогенангидридів
- 13. Дана реакція оборотна. Зворотний процес - розщеплення складного ефіру при дії води з утворенням карбонової кислоти
- 15. Жири Жири - складні ефіри гліцерину й вищих одноатомних карбонових кислот. Загальна назва таких сполук -
- 16. Продукт гідрогенізації масел - твердий жир (штучне сало, саломас). Маргарин - харчовий жир, складається із суміші
- 17. Установка для отримання води очищеної з кондуктометричним датчиком для контролю якості води очищеної
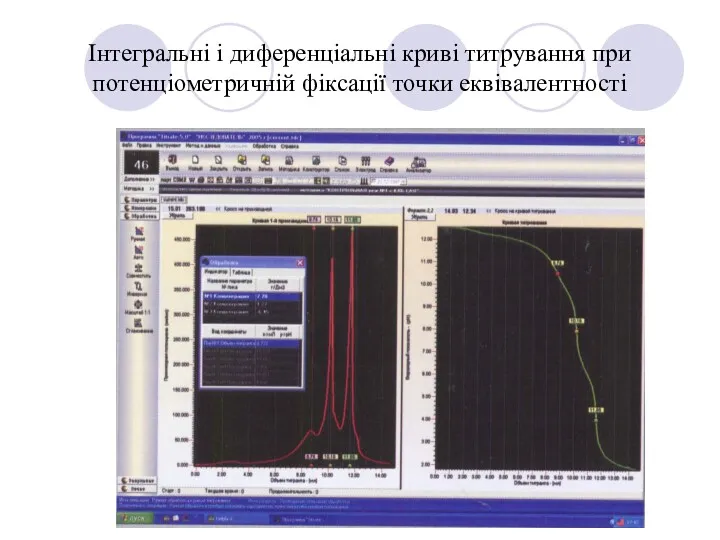
- 18. Інтегральні і диференціальні криві титрування при потенціометричній фіксації точки еквівалентності
- 20. Тема: Альдегіди і кетони 1. Номенклатура та ізомерія насичених альдегідів і кетонів. 2. Способи одержання альдегідів
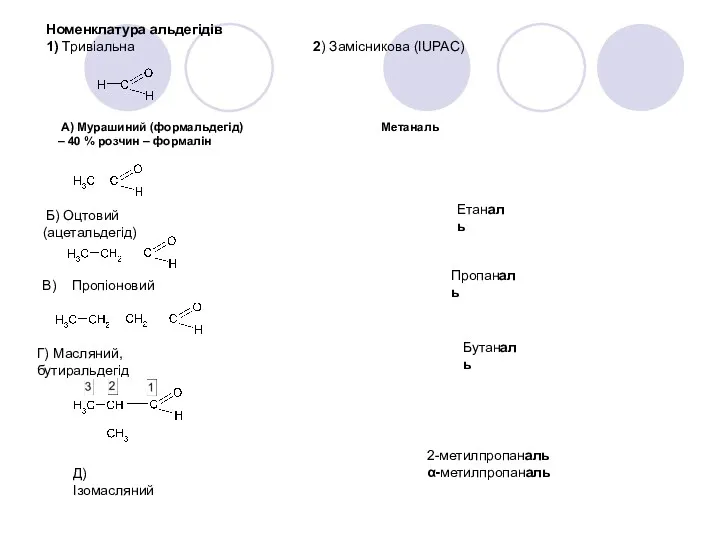
- 21. Номенклатура альдегідів 1) Тривіальна 2) Замісникова (IUPAC) А) Мурашиний (формальдегід) Метаналь – 40 % розчин –
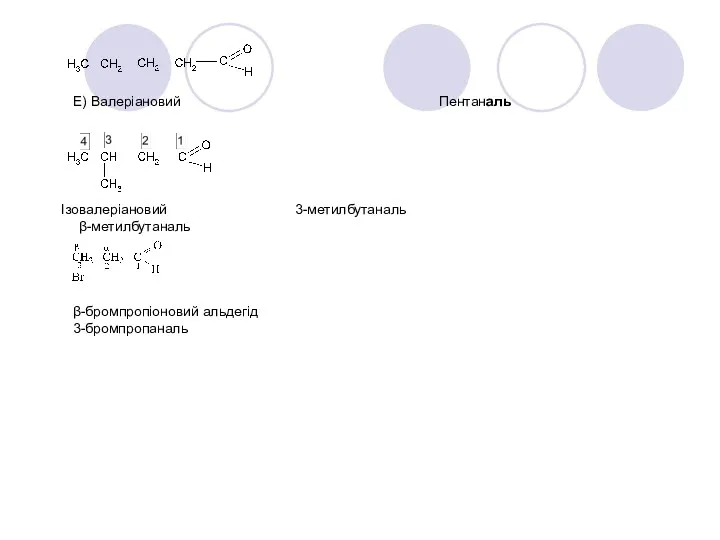
- 22. Е) Валеріановий Пентаналь Ізовалеріановий 3-метилбутаналь β-метилбутаналь β-бромпропіоновий альдегід 3-бромпропаналь
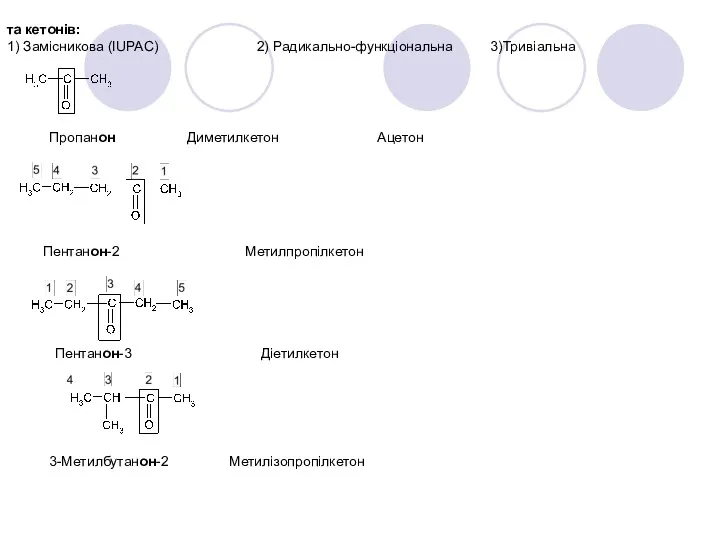
- 23. та кетонів: 1) Замісникова (IUPAC) 2) Радикально-функціональна 3)Тривіальна Пропанон Диметилкетон Ацетон Пентанон-2 Метилпропілкетон Пентанон-3 Діетилкетон 3-Метилбутанон-2
- 24. Введення альдегідної групи обумовлює наркотичну дію і дезинфікуючі властивості сполук. Препарати: 40 % р-н формальдегіду –
- 25. Ізомерія альдегідів та кетонів: Ізомерія вуглецевого скелету Для кетонів – положення функціональної групи. Міжкласова ізомерія між
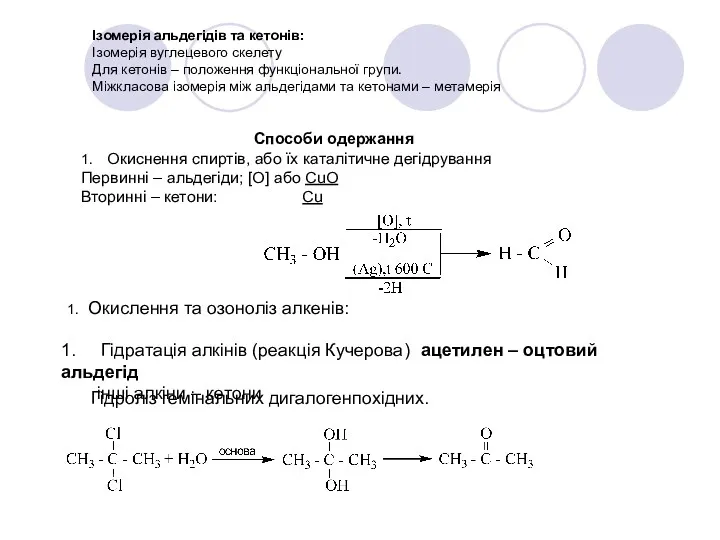
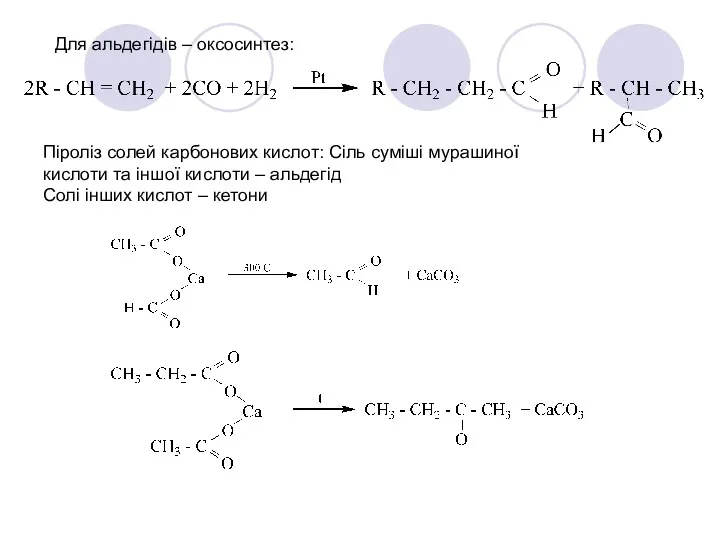
- 26. Для альдегідів – оксосинтез: Піроліз солей карбонових кислот: Сіль суміші мурашиної кислоти та іншої кислоти –
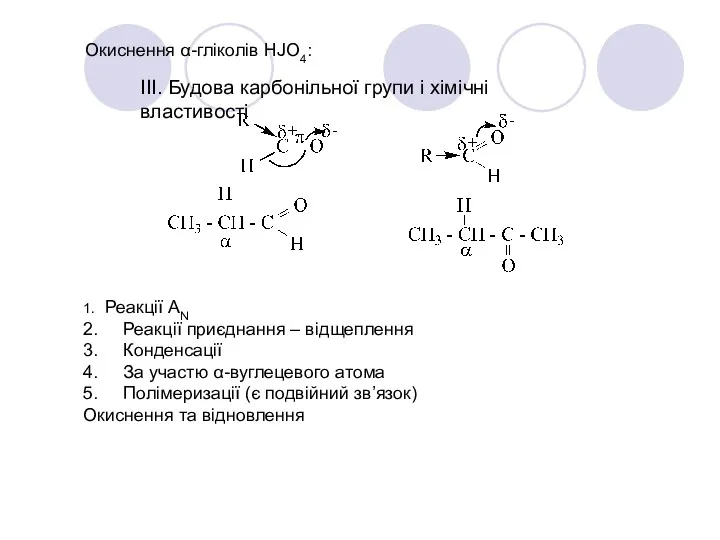
- 27. Окиснення α-гліколів HJO4: ІІІ. Будова карбонільної групи і хімічні властивості 1. Реакції АN 2. Реакції приєднання
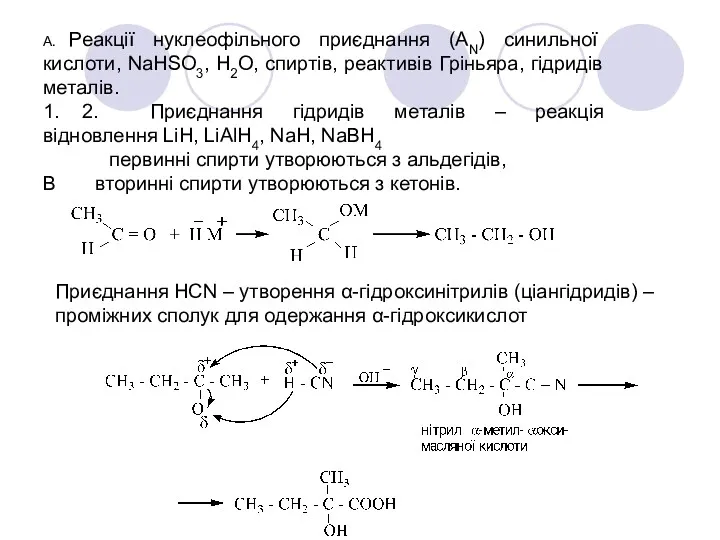
- 28. А. Реакції нуклеофільного приєднання (АN) синильної кислоти, NaHSO3, H2O, спиртів, реактивів Гріньяра, гідридів металів. 1. 2.
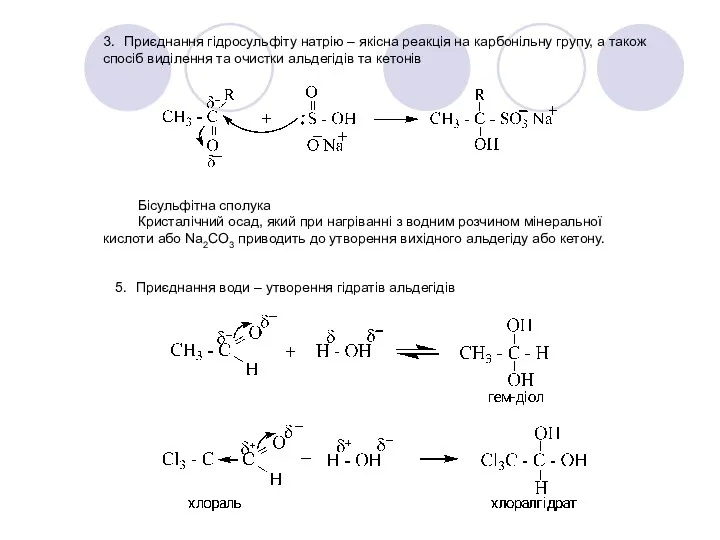
- 29. 3. Приєднання гідросульфіту натрію – якісна реакція на карбонільну групу, а також спосіб виділення та очистки
- 30. Якщо карбонільна група з’єднана з сильним електроноакцепторним замісником, то можна виділити гідрат, що утворився. В основі
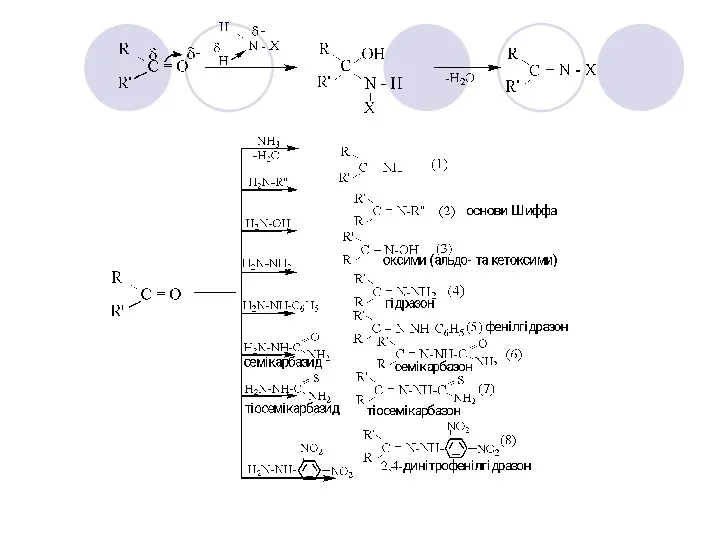
- 31. Ацеталі – стійкі в лужному середовищі, але легко гідролізуються до вільного альдегіду у вільних кислотах. Якщо
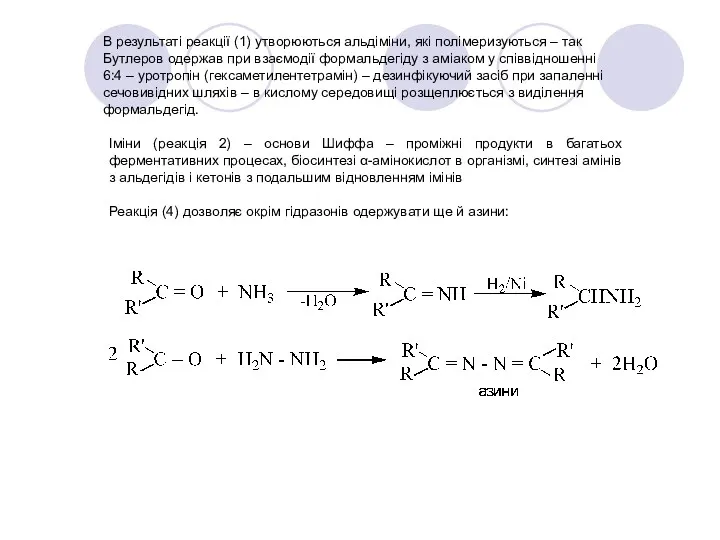
- 33. В результаті реакції (1) утворюються альдіміни, які полімеризуються – так Бутлеров одержав при взаємодії формальдегіду з
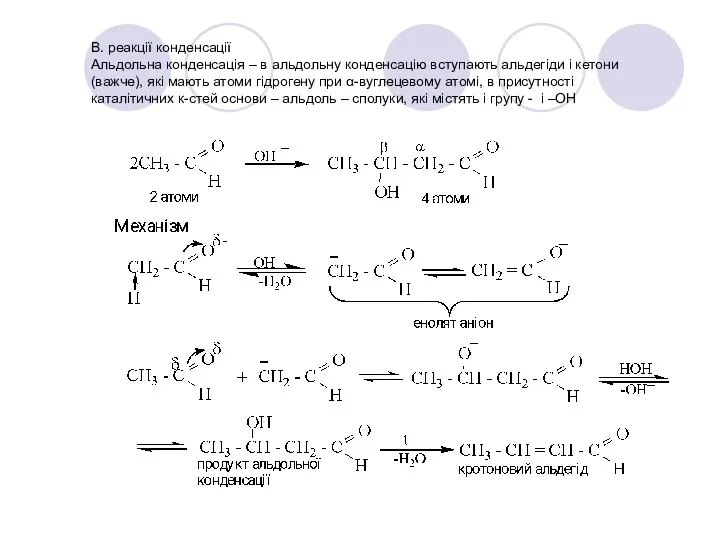
- 34. В. реакції конденсації Альдольна конденсація – в альдольну конденсацію вступають альдегіди і кетони (важче), які мають
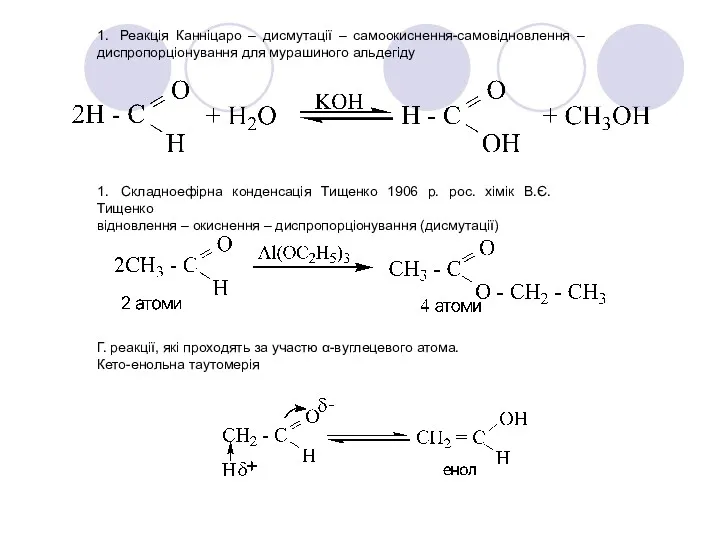
- 35. 1. Реакція Канніцаро – дисмутації – самоокиснення-самовідновлення – диспропорціонування для мурашиного альдегіду 1. Складноефірна конденсація Тищенко
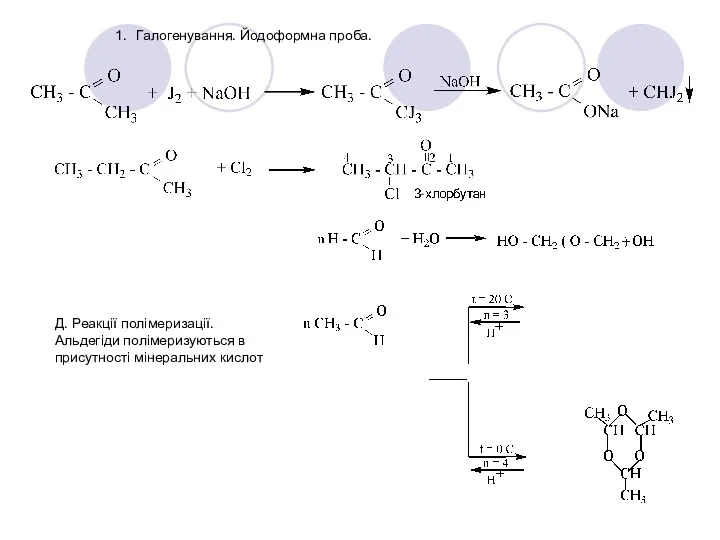
- 36. 1. Галогенування. Йодоформна проба. Д. Реакції полімеризації. Альдегіди полімеризуються в присутності мінеральних кислот
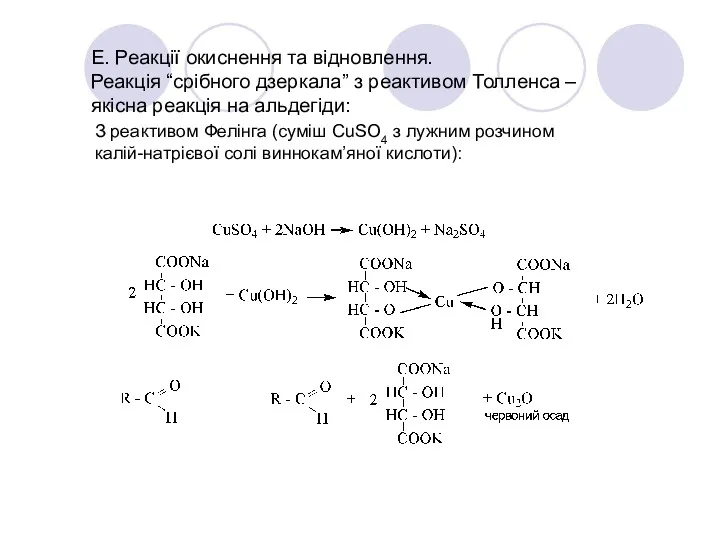
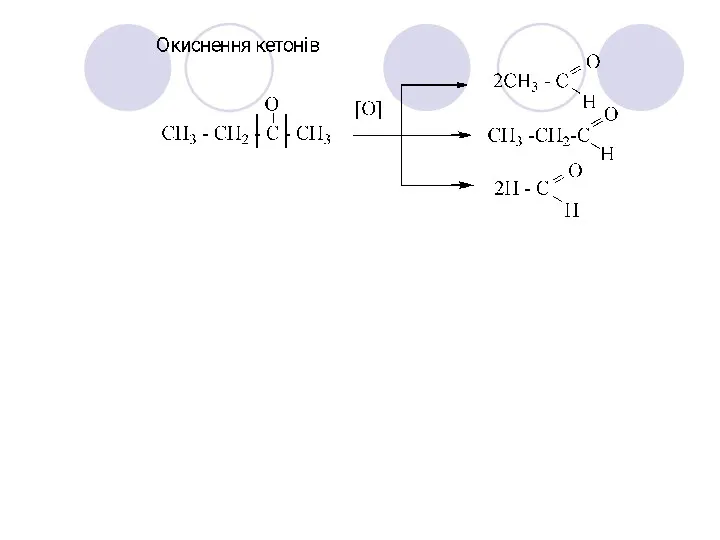
- 37. Е. Реакції окиснення та відновлення. Реакція “срібного дзеркала” з реактивом Толленса – якісна реакція на альдегіди:
- 40. Скачать презентацию












 Щелочные металлы
Щелочные металлы Organic Compounds
Organic Compounds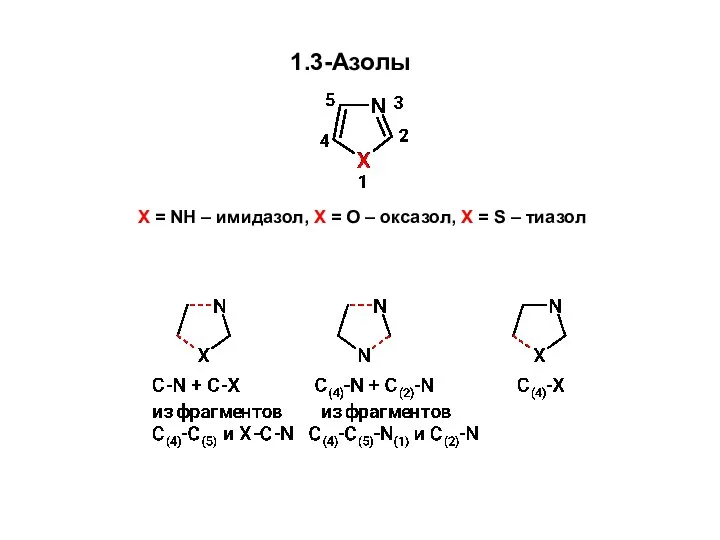 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алкоголь
Алкоголь Алюминий и его свойства
Алюминий и его свойства Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Молибден. Нахождение в природе
Молибден. Нахождение в природе Способы выражения состава растворов
Способы выражения состава растворов Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас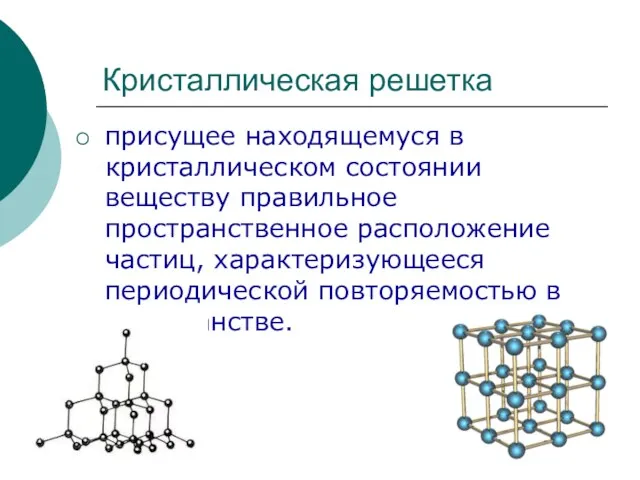 Кристаллическая решетка
Кристаллическая решетка Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Калийные удобрения
Калийные удобрения Введение в органическую химию
Введение в органическую химию Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР)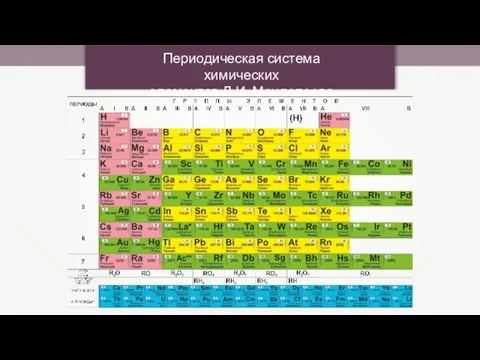 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Свойства минералов Лекция 3
Свойства минералов Лекция 3 Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Материаловедение. Лекция 1
Материаловедение. Лекция 1 Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Механическая смесь и растворы
Механическая смесь и растворы