Слайд 2

КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Слайд 3

Протонная теория Бренстеда-Лоури
Кислоты – нейтральные молекулы или ионы,
способные отдавать протон
Н+(доноры протона)
Кислотность - способность отдавать протон.
Основания - нейтральные молекулы или ионы,
способные присоединять протон Н+(акцепторы протона)
Основность – способность присоединять протон.
Кислота ↔ Н+ + Основание
Слайд 4

Элемент и связанный с ним потенциально способный к отщеплению атом Н
называют кислотным центром (КЦ).
Типы органических кислот
1) SH-кислоты: тиолы СН3-SH
2) ОН-кислоты: спирты СН3-ОH
3) NН-кислоты: амины СН3-NH2, амиды, имиды
4) CН-кислоты: углеводороды и их производные RСН2-СH3, RСН = СН2, RС ≡ СН
Слайд 5
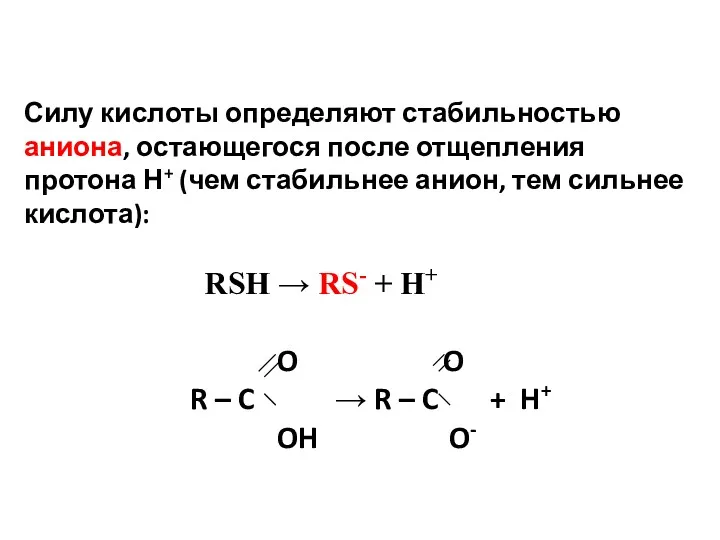
Силу кислоты определяют стабильностью аниона, остающегося после отщепления протона Н+ (чем
стабильнее анион, тем сильнее кислота):
RSH → RS- + H+
O O
R – C → R – C + H+
OH O-
Слайд 6

Факторы, влияющие на стабильность аниона
Слайд 7
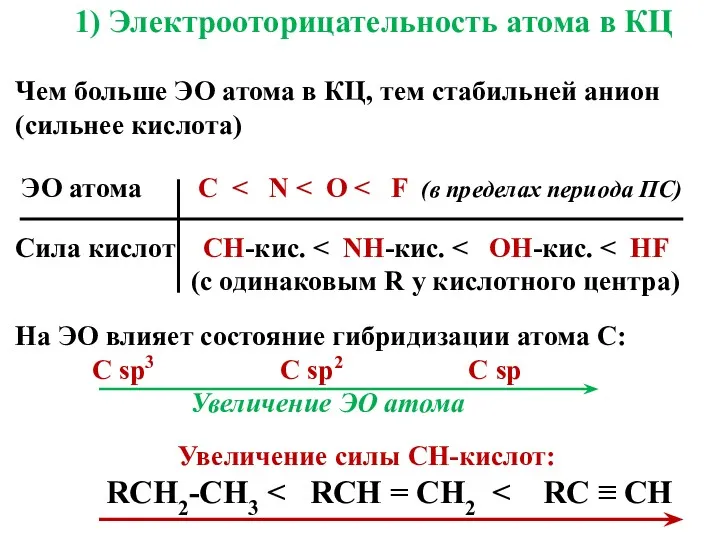
1) Электрооторицательность атома в КЦ
Чем больше ЭО атома в
КЦ, тем стабильней анион (сильнее кислота)
ЭО атома C < N < O < F (в пределах периода ПС)
Сила кислот CH-кис. < NH-кис. < OH-кис. < HF
(с одинаковым R у кислотного центра)
На ЭО влияет состояние гибридизации атома C: С sp3 С sp2 С sp
Увеличение ЭО атома Увеличение силы СН-кислот:
RСН2-СH3 < RСН = СН2 < RС ≡ СН
Слайд 8
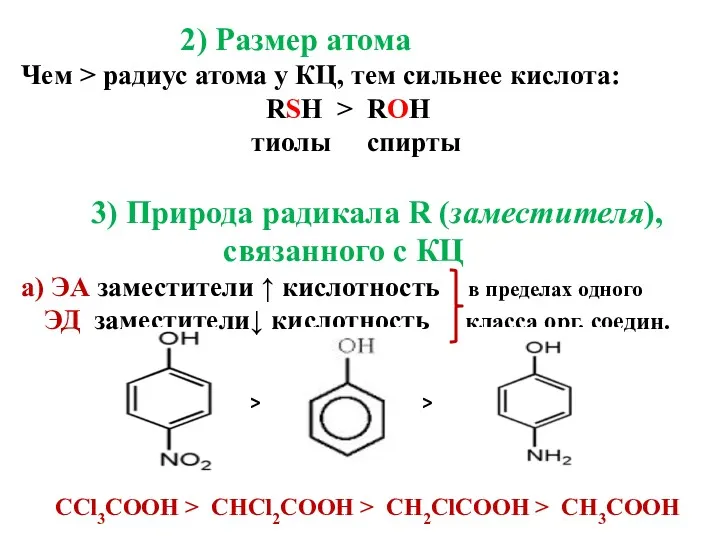
2) Размер атома
Чем > радиус атома у КЦ, тем сильнее
кислота: RSH > ROH
тиолы спирты
3) Природа радикала R (заместителя), связанного с КЦ
а) ЭА заместители ↑ кислотность в пределах одного ЭД заместители↓ кислотность класса орг. соедин. > > CCl3COOH > CHCl2COOH > CH2ClCOOH > CH3COOH
Слайд 9

б) Размер R: чем длиннее углеводородный R, тем слабее кислота
HCOOH > CH3COOH > CH3CH2COOH
Уменьшение силы кислоты
Слайд 10

4) Растворитель
Чем лучше гидратирован ион (чем меньше его размер), тем
сильнее кислота:
RCOOH > Ar-OH > R-SH > R-OH > R-NH2 > R-H
карбоновые фенолы тиолы спирты амины у/в
кислоты
На силу оснований Бренстеда влияют те же факторы, но в обратном направлении
Слайд 11

Электронная теория кислот и оснований (теория Льюиса)
Кислоты - соединения,
принимающие е пару (акцепторы е-в)
Основания - соединения, предоставляющие е пару (доноры е-в)
BF3 + R – – R → R – O+ – R кислота основание BF3-
СН3 – + AlCl3 → CH3 – Cl+ - -AlCl3
основание кислота
Слайд 12

РЕАКЦИОННАЯ СПОСОБНОСТЬ СПИРТОВ, ЭФИРОВ, ФЕНОЛОВ
И ИХ ТИОАНАЛОГОВ
Слайд 13

Спирты (алкоголи) –
производные углеводородов, содержащие одну или несколько функциональных
групп
-ОН
Слайд 14
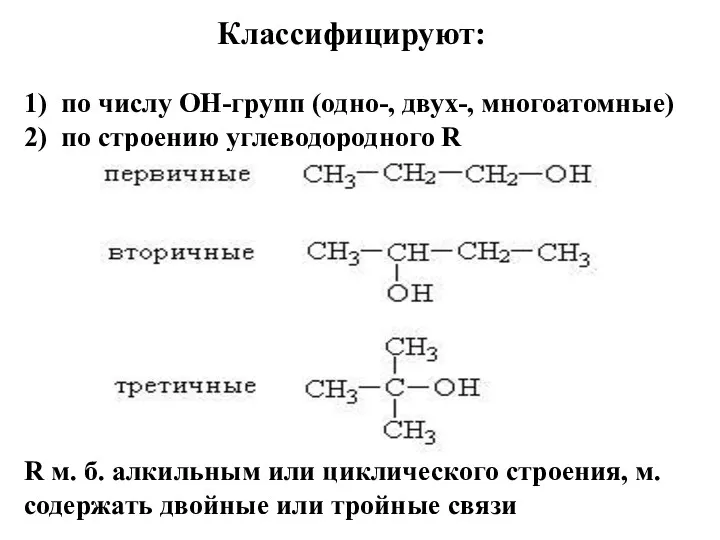
Классифицируют:
1) по числу ОН-групп (одно-, двух-, многоатомные)
2) по
строению углеводородного R
R м. б. алкильным или циклического строения, м. содержать двойные или тройные связи
Слайд 15
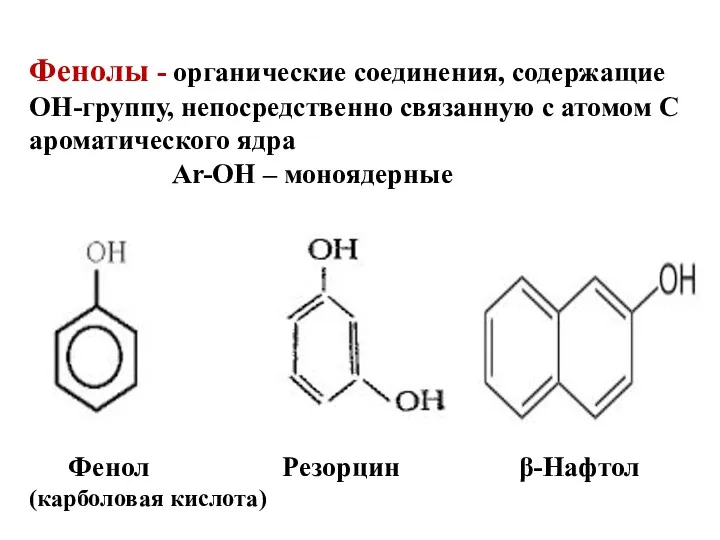
Фенолы - органические соединения, содержащие ОН-группу, непосредственно связанную с атомом С
ароматического ядра
Ar-OH – моноядерные
Фенол Резорцин β-Нафтол
(карболовая кислота)
Слайд 16

Химические свойства
фенолов и спиртов определяются наличием полярных связей
С
- О и О - Н
Слайд 17
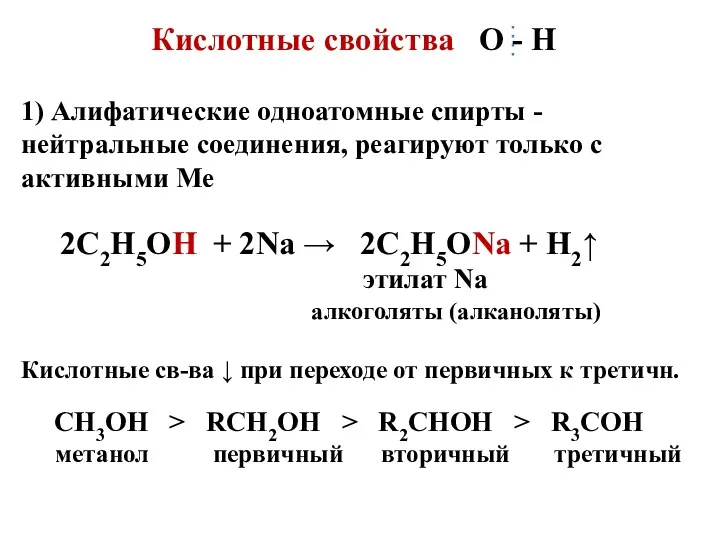
Кислотные свойства О - Н
1) Алифатические одноатомные спирты -
нейтральные соединения, реагируют только с активными Ме
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑
этилат Na
алкоголяты (алканоляты)
Кислотные св-ва ↓ при переходе от первичных к третичн.
СН3ОН > RCH2OH > R2CHOH > R3COH
метанол первичный вторичный третичный
Слайд 18
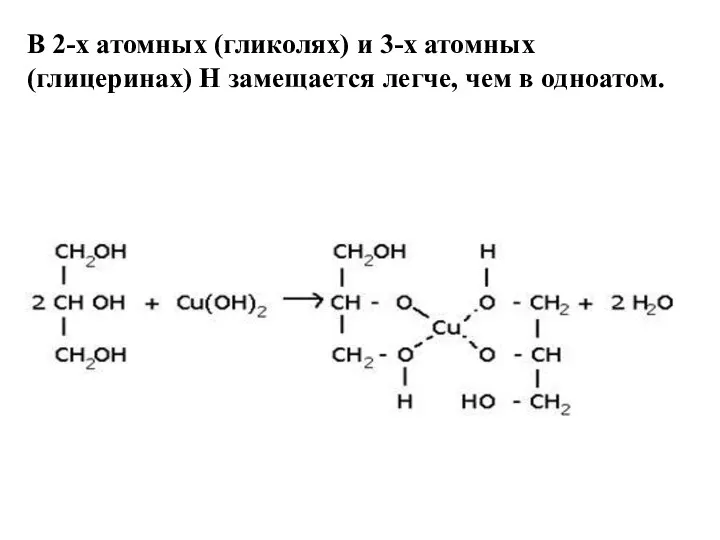
В 2-х атомных (гликолях) и 3-х атомных (глицеринах) Н замещается легче,
чем в одноатом.
Слайд 19
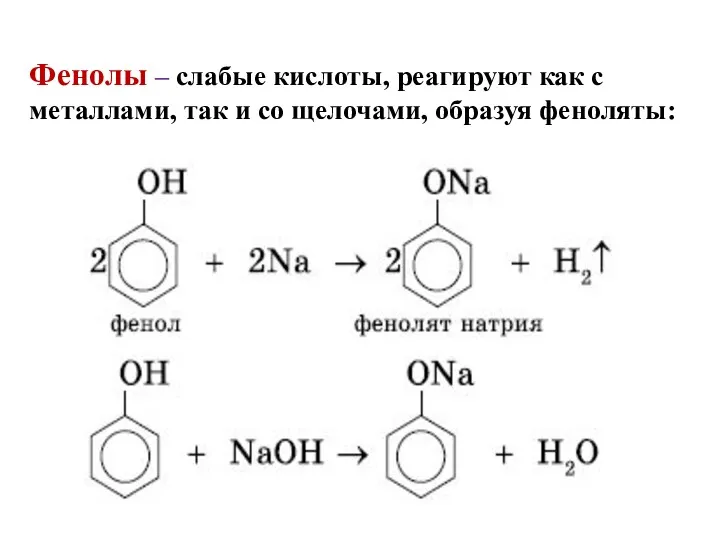
Фенолы – слабые кислоты, реагируют как с металлами, так и со
щелочами, образуя феноляты:
ф
Слайд 20

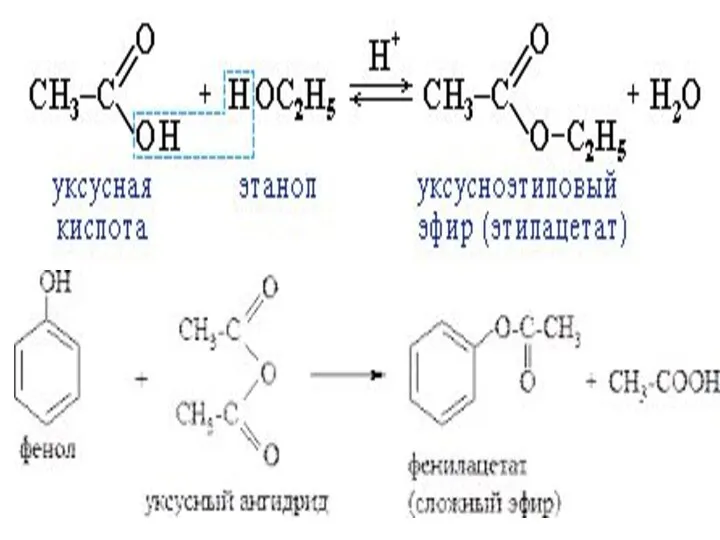
Реакция этерификации
(образование сложных эфиров)
Слайд 21
Слайд 22
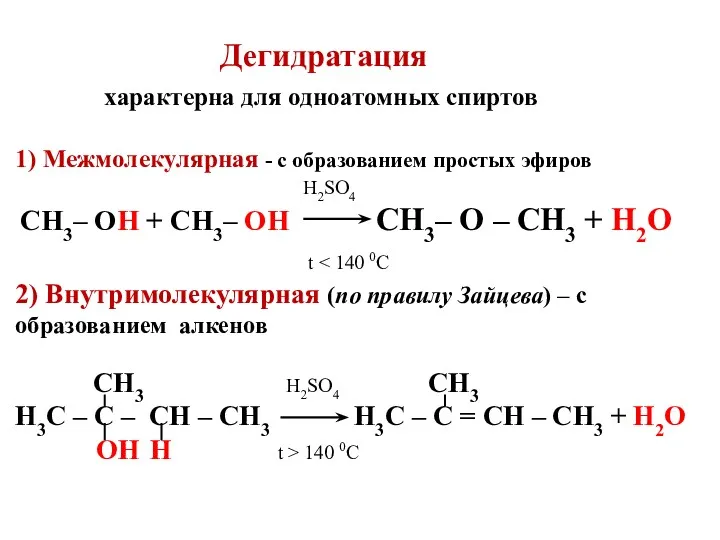
Дегидратация
характерна для одноатомных спиртов
1) Межмолекулярная - с образованием простых
эфиров
H2SO4
СН3– ОН + СН3– ОН СН3– О – СН3 + Н2О t < 140 0C
2) Внутримолекулярная (по правилу Зайцева) – с образованием алкенов СН3 H2SO4 СН3
Н3С – С – СН – СН3 Н3С – С = СН – СН3 + Н2О ОН Н t > 140 0C
Слайд 23
![Реакции окисления Третичные спирты не окисляются Фенолы + [О] → Кетоны:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/222183/slide-22.jpg)
Реакции окисления
Третичные спирты не окисляются
Фенолы + [О] →
Кетоны:
Слайд 24
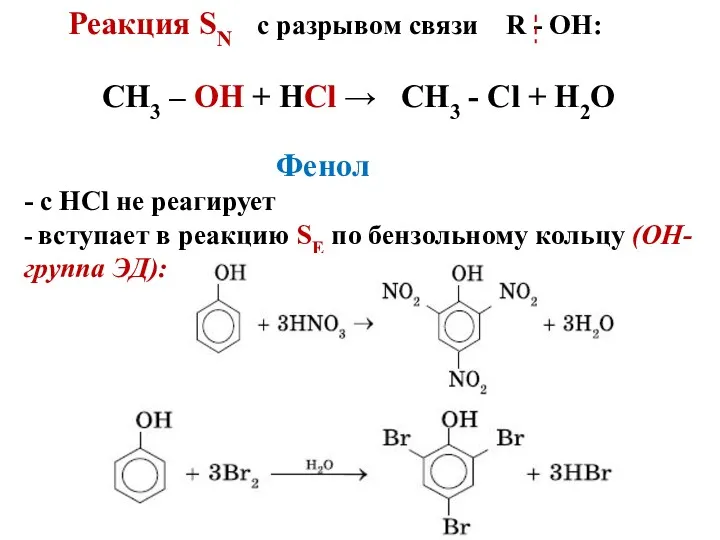
Реакция SN с разрывом связи R - OH:
СН3 –
ОН + HCl → CH3 - Cl + H2O Фенол
- с HCl не реагирует
- вступает в реакцию SЕ по бензольному кольцу (ОН-группа ЭД):
Слайд 25
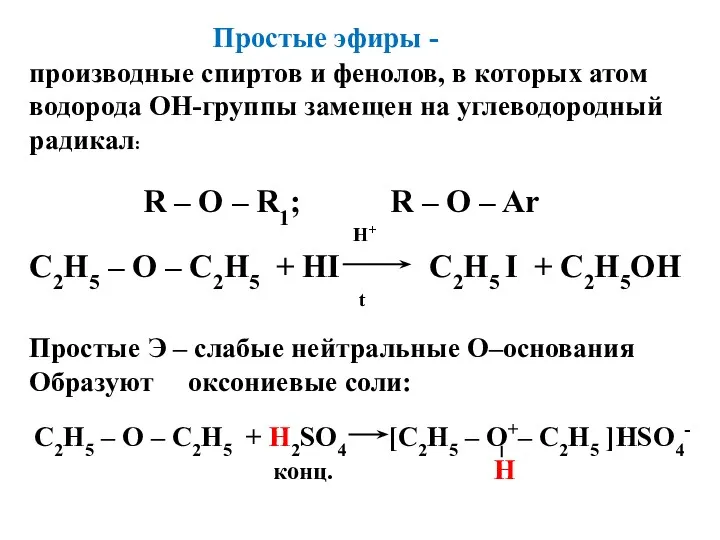
Простые эфиры -
производные спиртов и фенолов, в которых атом водорода
ОН-группы замещен на углеводородный радикал:
R – O – R1; R – O – Ar
H+
С2Н5 – О – С2Н5 + HI С2Н5 I + С2Н5OH
t
Простые Э – слабые нейтральные О–основания
Образуют оксониевые соли:
С2Н5 – О – С2Н5 + H2SO4 [С2Н5 – О+– С2Н5 ]HSO4-
конц. H
Слайд 26
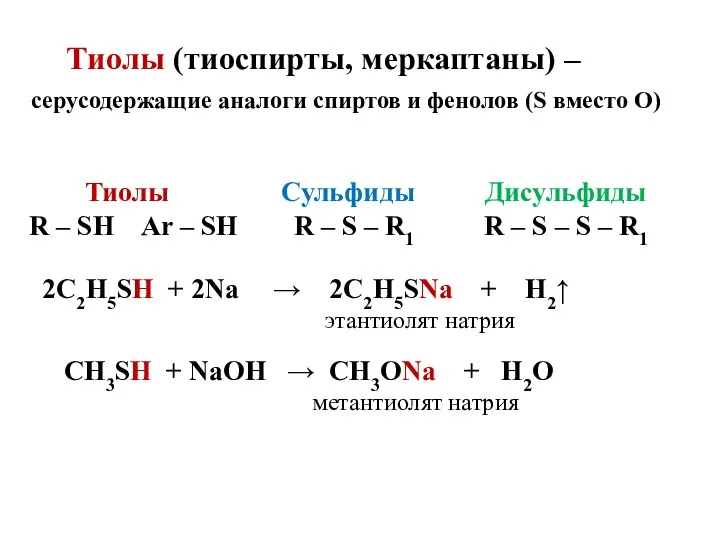
Тиолы (тиоспирты, меркаптаны) –
серусодержащие аналоги спиртов и фенолов (S
вместо О)
Тиолы Сульфиды Дисульфиды
R – SH Ar – SH R – S – R1 R – S – S – R1
2С2Н5SН + 2Na → 2C2H5SNa + H2↑ этантиолят натрия
СН3SН + NaOH → CH3ONa + H2O
метантиолят натрия





















![Реакции окисления Третичные спирты не окисляются Фенолы + [О] → Кетоны:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/222183/slide-22.jpg)



 Разнообразие неметаллов
Разнообразие неметаллов Подгруппа углерода
Подгруппа углерода Метод МО
Метод МО Химия и производство
Химия и производство Реакции подлинности лекарственных веществ
Реакции подлинности лекарственных веществ Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Кремний и его соединения
Кремний и его соединения Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химическая кинетика и катализ
Химическая кинетика и катализ Происхождение химических элементов
Происхождение химических элементов Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) Липиды. Составные части липидов
Липиды. Составные части липидов Chemical Equilibrium. Topic 3.3
Chemical Equilibrium. Topic 3.3 Дефекты в твердых телах
Дефекты в твердых телах Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Циклоалканы
Циклоалканы Пиролиз нефтяного сырья
Пиролиз нефтяного сырья Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Симметрия в химии. Кристаллы
Симметрия в химии. Кристаллы Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция АЛЮМИНИЙ
АЛЮМИНИЙ