Содержание
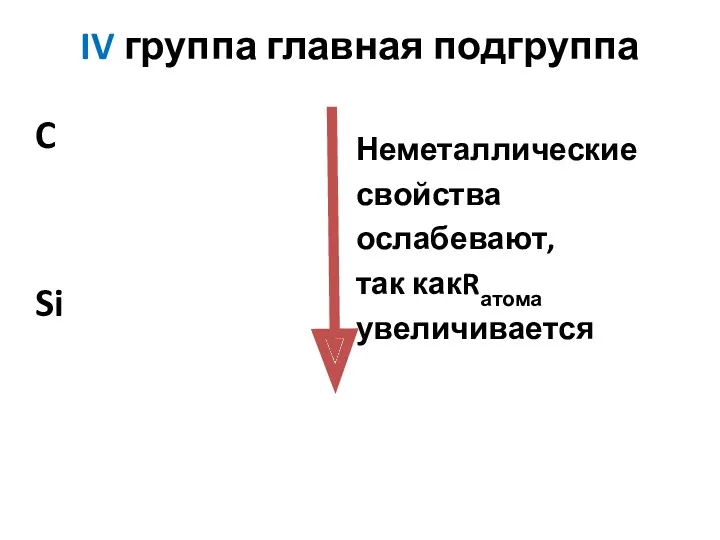
- 2. C Si Bi Неметаллические свойства ослабевают, так какRатома увеличивается IV группа главная подгруппа
- 3. УГЛЕРОД
- 4. СТЕПЕНИ ОКИСЛЕНИЯ УГЛЕРОДА Низшая с/о: -4 (СH4-метан; M4Nn-карбиды ) Высшая с/о: +4 (СО2- углекислый газ H2CO3
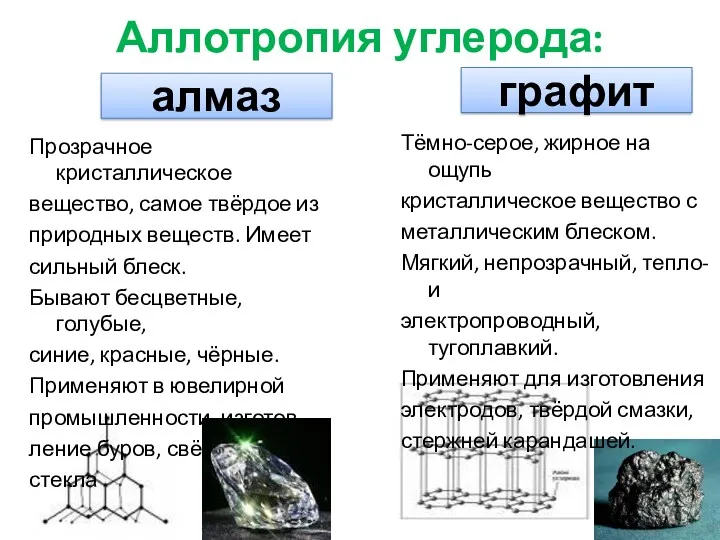
- 5. алмаз графит Аллотропия углерода: Прозрачное кристаллическое вещество, самое твёрдое из природных веществ. Имеет сильный блеск. Бывают
- 6. Что такое адсорбция? Что называют активированным углём? Где он используется?
- 7. ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА а) горение С + О2→ СО2 б) с металлами с образованием карбидов: 4
- 8. Кислородные соединения углерода
- 9. ОКСИДЫ
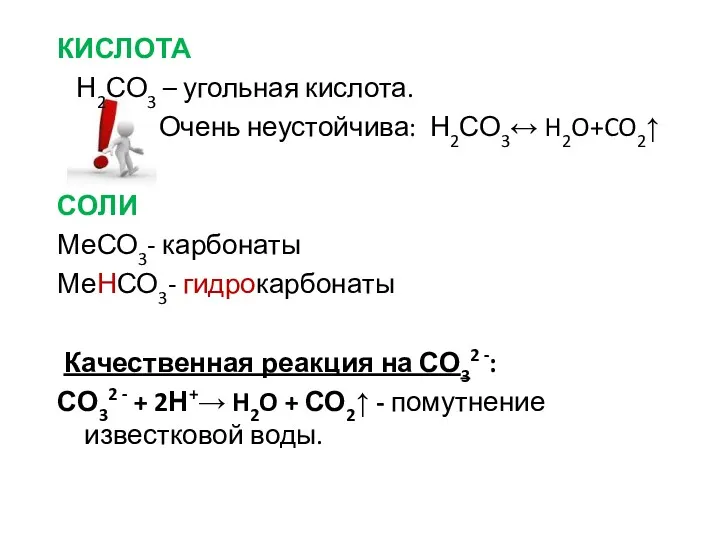
- 10. КИСЛОТА Н2СО3 – угольная кислота. Очень неустойчива: Н2СО3↔ H2O+CO2↑ СОЛИ МеСО3- карбонаты МеНСО3- гидрокарбонаты Качественная реакция
- 11. КРЕМНИЙ https://www.youtube.com/watch?v=Z-cPNz9uKdg (Посмотри видеоролик!)
- 12. СТЕПЕНИ ОКИСЛЕНИЯ КРЕМНИЯ Низшая с/о: -4 (SiH4-силан; M4Sin-силициды ) Высшая с/о: +4 (SiО2 H2SiO3 –кремневая кислота
- 13. Физические свойства кремния Кремний – неметалл, существует в кристаллическом и аморфном состоянии. Кристаллический кремний – вещество
- 14. Лабораторный способ получения кремния: SiO2 + 2 Mg ? 2MgO + Si
- 15. Химические свойства кремния Химически кремний малоактивен. При комнатной температуре: Si + 2F2? SiF4 При нагревании: Si
- 16. Соединения кремния
- 17. SiH4-силан бесцветный газ с неприятным запахом, воспламеняется на воздухе Получение: Ca2Si + 4HCl → 2CaCl2 +
- 18. SiО2-оксид кремния, песок, кремнезём, кварц Бесцветные и различно окрашенные кристаллы SiO2 – драгоценные камни. Кварц встречается
- 19. Разновидности минералов на основе оксида кремния Агат Горный хрусталь Кварц Цитрин Кошачий глаз Аметист Яшма Сердолик
- 20. Просвечивающие кристаллы дымчатого кварца и морион используется в ювелирных изделиях и декоративных работах.
- 21. Дымчатый кварц
- 22. Аметист Аметист выделяется среди прочих разновидностей кварца особой красотой. Его цветовая гамма колеблется от нежно-сиреневой до
- 23. Аметист
- 24. Песок
- 25. ОКСИД КРЕМНИЯ (SiO2 ) 1)SiO2 + 2 Mg → 2MgO + Si 4)SiO2 + 4HF→ SiF4↑
- 26. Н2SiО3-кремневая кислота Нерастворима, находится в виде студня. Если студень кремневой кислоты частично обезводить, то образуется твердая
- 27. Соли – силикаты МSiО3 Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не
- 28. Применение кремния и его соединений Стекло Цемент Кирпич Фарфор Фаянс Клей Силикон Асбест Гранит Керамика
- 29. Применение кремния в технике
- 30. Применение кремния в медицине
- 31. Биологическая роль Важнейшее соединение кремния – SiO2 необходим для жизни растений и животных. Благодаря ему тростники,
- 32. Биологическая роль Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как
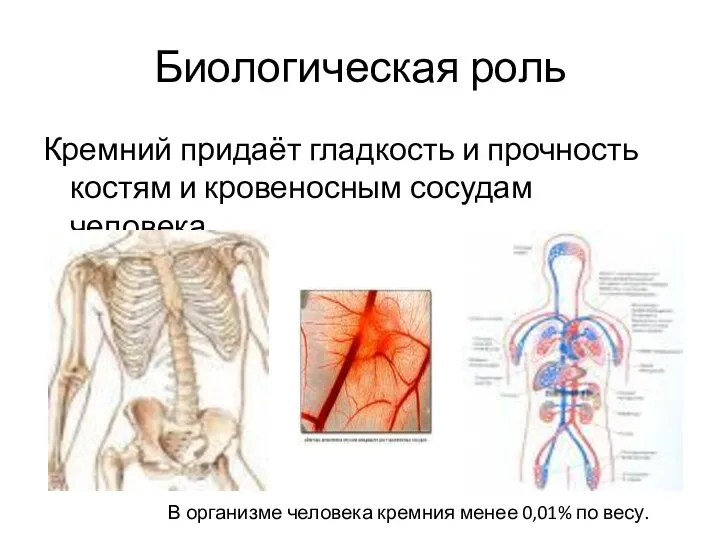
- 33. Биологическая роль Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека. В организме человека кремния
- 34. Биологическая роль Кремний входит и в состав низших живых организмов – диатомовых водорослей и радиолярий, -
- 35. Кремний в продуктах питания
- 36. ТЕСТ 1 вариант (если ваша фамилия начинается на буквы А-В) 1.Тип кристаллической решетки графита: а) молекулярная;
- 37. ТЕСТ 2 вариант (если ваша фамилия начинается на буквы Г-З) 1.Тип кристаллической решетки алмаза: а) молекулярная;
- 38. ТЕСТ 3 вариант (если ваша фамилия начинается на буквы К-С) 1.Сырье для производства керамических изделий служит:
- 40. Скачать презентацию

































 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие