Содержание
- 2. Цели урока: Знать строение и свойства серной кислоты. Уметь составлять уравнения реакций, отражающие свойства этих веществ.
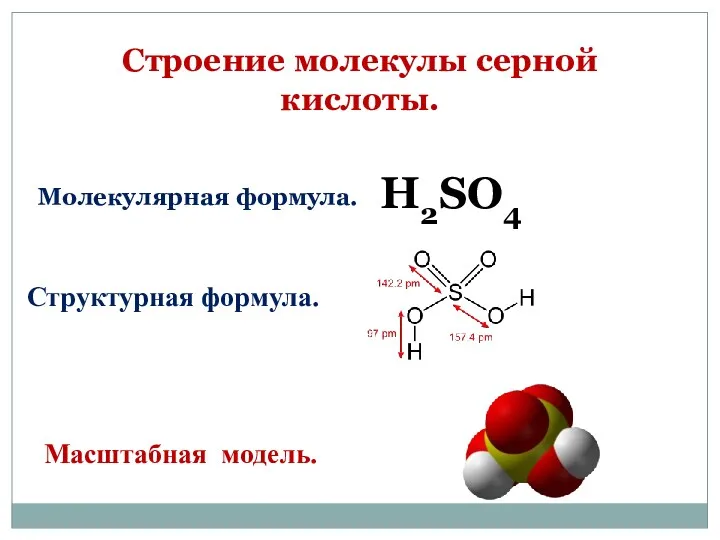
- 3. Строение молекулы серной кислоты. Масштабная модель. Структурная формула. H2SO4 Молекулярная формула.
- 4. Серная кислота H2SO4, сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,9203 г/см³, tпл
- 5. Получение Сырьем для получения серной кислоты служат: S,сульфиды металлов,H2S, отходящие газы теплоэлектростанций, сульфаты Fe, Ca и
- 6. Серная кислота H2SO4 Серная кислота сильная, т.е. в водных растворах полностью распадается на ионы: H2SO4 =
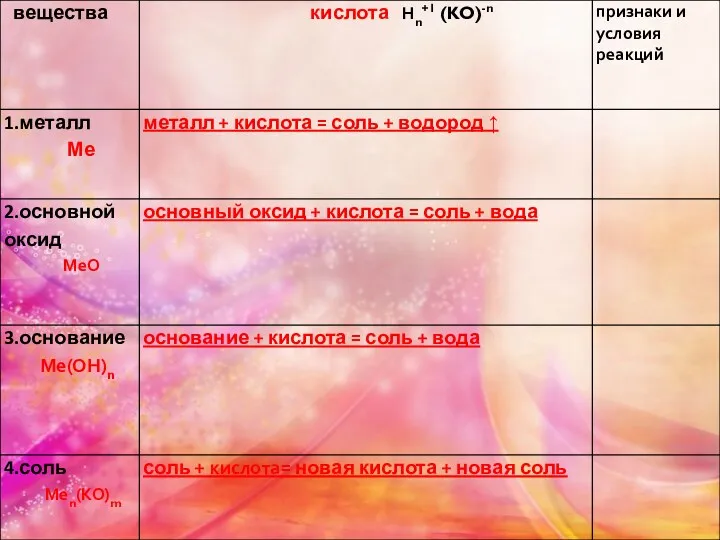
- 8. Химические разбавленной серной кислоты Кислотные свойства А. Взаимодействие с металлами, стоящими в ряду активности до водорода:
- 9. Б. С оксидами металлов: H2SO4 + CuO = CuSO4 + H2O Допишите: H2SO4 + ZnO= (самостоятельно)
- 10. В. С гидроксидами металлов: H2SO4 + NaOH → H2SO4 + 2NaOH → Na2SO4 + 2H2O Допишите:
- 11. Г. С солями (при условии, если образуется осадок или газ). H2SO4 + BaCI2 → H2SO4 +
- 12. Приготовление раствора серной кислоты. Вода легче серной кислоты. При вливании воды в серную кислоту, при контакте
- 13. Правила техники безопасности при работе с серной кислотой. •Работать в перчатках. •При попадании кислоты на кожу
- 14. Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом и алюминием в результате пассивации металлов.
- 15. Концентрированная серная кислота -довольно сильный окислитель, особенно при нагревании.; окисляет HI и частично НВг до свободных
- 16. Продуктами восстановления кислоты обычно является оксид серы (IV), сероводород и сера (H2S и S) образуется в
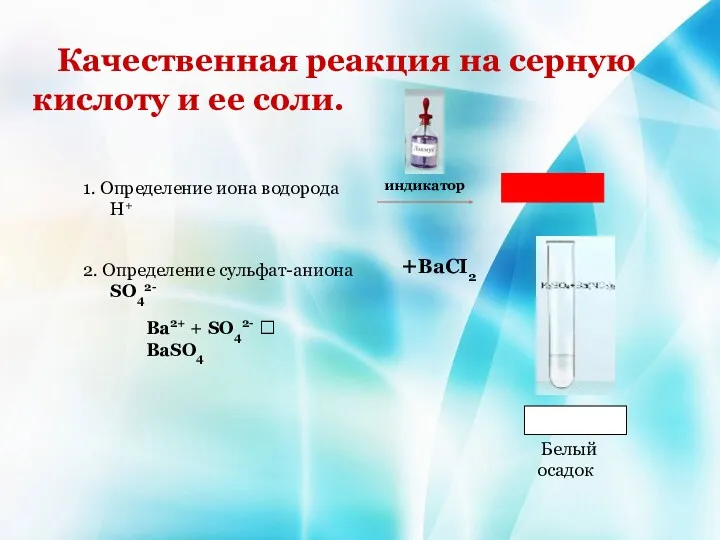
- 17. Качественная реакция на серную кислоту и ее соли. 1. Определение иона водорода Н+ индикатор 2. Определение
- 18. Перечислите общие свойства раствора серной кислоты H2SO4 MeXOY Mex Oy Me(OH)n Соль Соль +H2 Соль +H2O
- 20. С какими из перечисленных веществ может вступить во взаимодействие серная кислота, находящаяся в водном растворе: H2SO4
- 21. Ответьте на вопросы. 1.Что нового вы узнали сегодня о кислотах? 2.Какие из изученных сегодня вопросов вызвали
- 23. Скачать презентацию

















 Крахма́л (C6H10O5)n
Крахма́л (C6H10O5)n Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения Химические волокна
Химические волокна Классификация химических реакций
Классификация химических реакций Щелочные металлы
Щелочные металлы Промышленное производство аммиака
Промышленное производство аммиака Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Создание косметических средств
Создание косметических средств Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Калийные Удобрения
Калийные Удобрения Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Количество вещества. Моль
Количество вещества. Моль Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Галогены. Общая характеристика галогенов
Галогены. Общая характеристика галогенов Аммиак
Аммиак Технология переработки полимеров
Технология переработки полимеров Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Алюминий и его соединения
Алюминий и его соединения Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены