Слайд 2
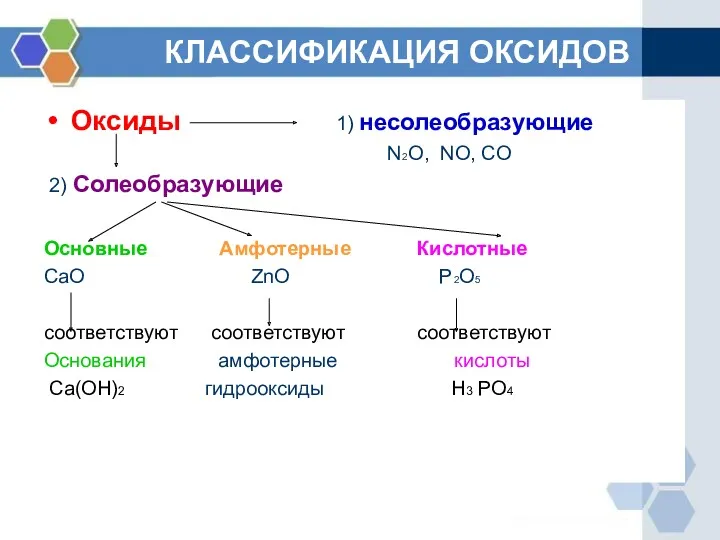
КЛАССИФИКАЦИЯ ОКСИДОВ
Оксиды 1) несолеобразующие
N2O, NO, CO
2) Солеобразующие
Основные Амфотерные Кислотные
CaO
ZnO P2O5
соответствуют соответствуют соответствуют
Основания амфотерные кислоты
Ca(OH)2 гидрооксиды H3 PO4
Слайд 3

ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
Основными называются оксиды, которые образуют соли при взаимодействии с
кислотами или кислотными оксидами.
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
Амфотерными оксидами, называют оксиды которые проявляют свойства как кислот, так и оснований.
Слайд 4

НАПМИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ
1)Оксид серы(IV)
2)Оксид азота(V)
3)Оксид калия (I)
4)Оксид железа(II)
5)Оксид фосфора(V)
6) оксид натрия (I)
Слайд 5
Слайд 6

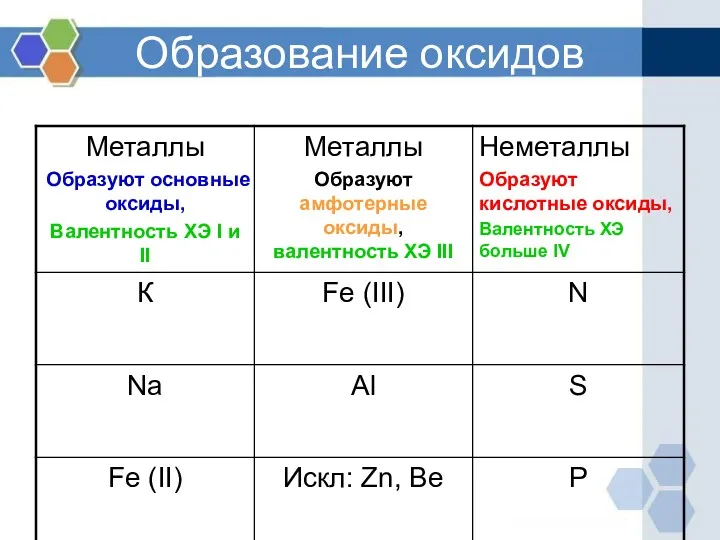
ФОРМУЛЫ ОКСИДОВ
1)Оксид серы(IV)
2)Оксид азота(V)
3)Оксид калия (I)
4)Оксид
железа(II)
5)Оксид фосфора(V)
6) оксид натрия (I)
Слайд 7
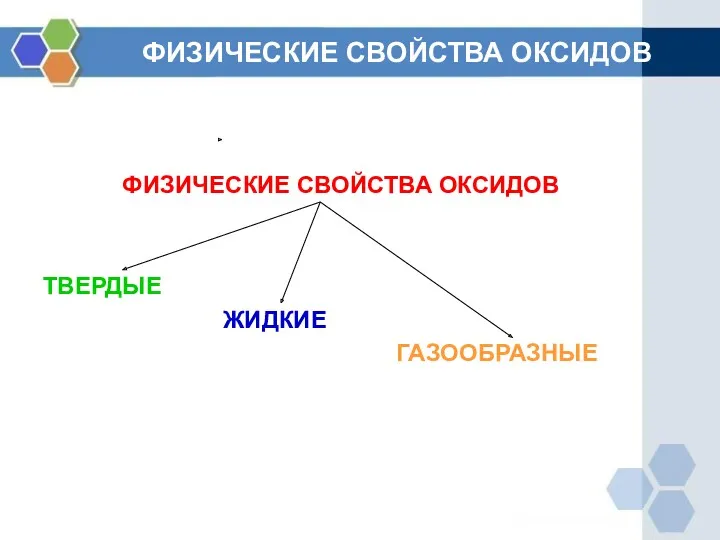
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ТВЕРДЫЕ
ЖИДКИЕ
ГАЗООБРАЗНЫЕ
Слайд 8

ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода
(реакция обмена)
CaO + H2 SO4 → CaSO4 + H2O
2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2O + H2O → 2NaOH
Слайд 9

Химические свойства кислотных оксидов (К.О.)
1) К.О. + основание = соль +
вода (реакция обмена)
SO3 + 2NaOH → Na2SO4 + H2O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO3 + Na2O → Na2SO4.
3) К.О. + вода = кислота (кроме SiO2 )
(реакция соединения)
P2O5 + 3H2O → 2H3PO4
Слайд 10

Амфотерные оксиды
1) с кислотами как основные
ZnO + 2HCl =
ZnCl2 + H2O
2) с основаниями как кислотные
ZnO + 2NaOH = Na2ZnO + H2O
(цинкат натрия)
ZnO + 2NaOH +H2O = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)









 Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Химия көшбасшысы
Химия көшбасшысы Галогены. Свойства галогенов
Галогены. Свойства галогенов Алкани
Алкани Применение серной кислоты
Применение серной кислоты Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Сера. Нахождение в природе. Химические свойства серы
Сера. Нахождение в природе. Химические свойства серы Электролиз Урок для 11 класса
Электролиз Урок для 11 класса Породообразующие минералы
Породообразующие минералы Лекции по курсу конструкционные и биоматериалы
Лекции по курсу конструкционные и биоматериалы Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску
Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску Количество вещества. Моль
Количество вещества. Моль Хлор
Хлор Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Кислотно-основные свойства органических соединений. (Лекция 3)
Кислотно-основные свойства органических соединений. (Лекция 3) Теория электролитической диссоциации
Теория электролитической диссоциации Синтетические моющие средства
Синтетические моющие средства Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Неорганика. Подготовка к ЕГЭ-2020
Неорганика. Подготовка к ЕГЭ-2020 Алкины. Ацетилен.
Алкины. Ацетилен. Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі. Лекція №27
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі. Лекція №27 Группа ультраосновных пород
Группа ультраосновных пород Общая и неорганическая химия
Общая и неорганическая химия Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева