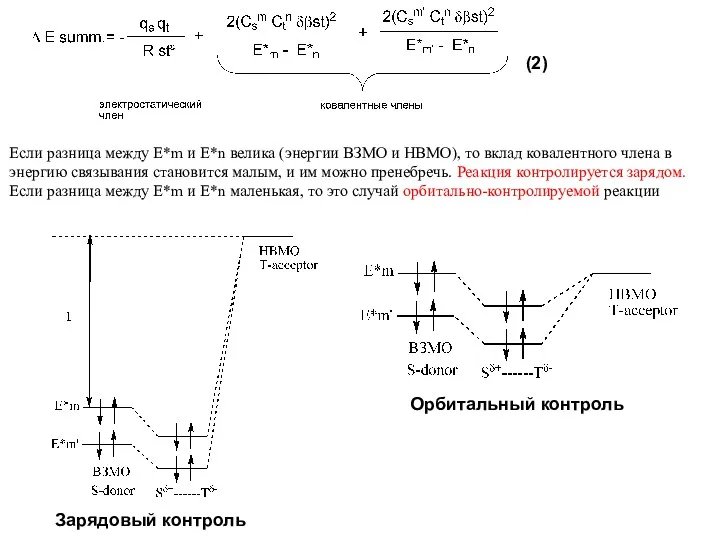
6.1.3. Жесткие и мягкие кислоты и основания (принцип ЖМКО):
Мягкие основания. Атомы-доноры
имеют низкую электроотрицательность и высокую поляризуемость. Они легко окисляются, валентные электроны в них сравнительно слабо удерживаются (низкие потенциалы ионизации).
Жесткие основания. Атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость; окисляются с трудом; валентные электроны удерживаются прочно (высокие потенциалы ионизации).
Мягкие кислоты. Атомы-акцепторы имеют крупные размеры, несут низкий положительный заряд; на валентных оболочках имеют неподеленные электронные пары ( p или d). Обладают высокой поляризуемостью и низкой электроотрицательностью.
Жесткие кислоты. Атомы-акцепторы маленькие, несут высокий положительный заряд; на валентных оболочках не имеется неподеленных электронных пар. Обладают низкой поляризуемостью и высокой электроотрицательностью.
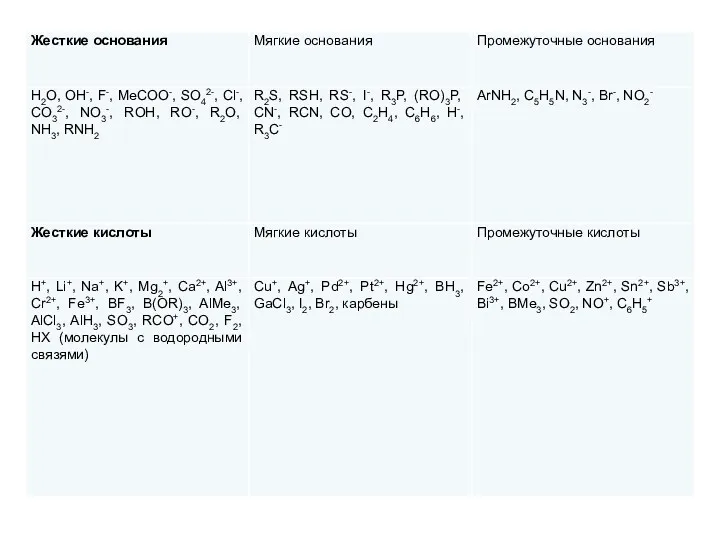
По жесткости и мягкости кислоты и основания можно расположить в определенном порядке (приблизительно); например, мягкость оснований убывает в ряду I->Br->Cl->F- и в ряду CH3->NH2->OH->F-. Однако, поскольку это свойство не имеет точного количественного выражения, целесообразней разделить их на три группы: жесткие, мягкие и промежуточные






 Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Химиялық элемент оттегі
Химиялық элемент оттегі Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Дефекты в твердых телах
Дефекты в твердых телах Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Альдегіди. Будова молекул
Альдегіди. Будова молекул Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Механизм реакции в органической химии
Механизм реакции в органической химии Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот)
Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот) В мире криссталлов
В мире криссталлов Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Железо и его сплавы
Железо и его сплавы Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Вирощення кристталів
Вирощення кристталів Игра-квест на уроке химии
Игра-квест на уроке химии Кислород. Открытие кислорода
Кислород. Открытие кислорода Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация
Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация