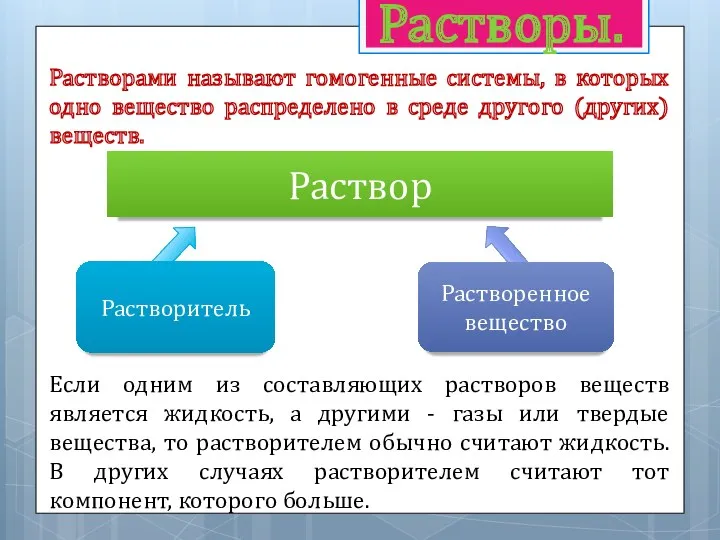
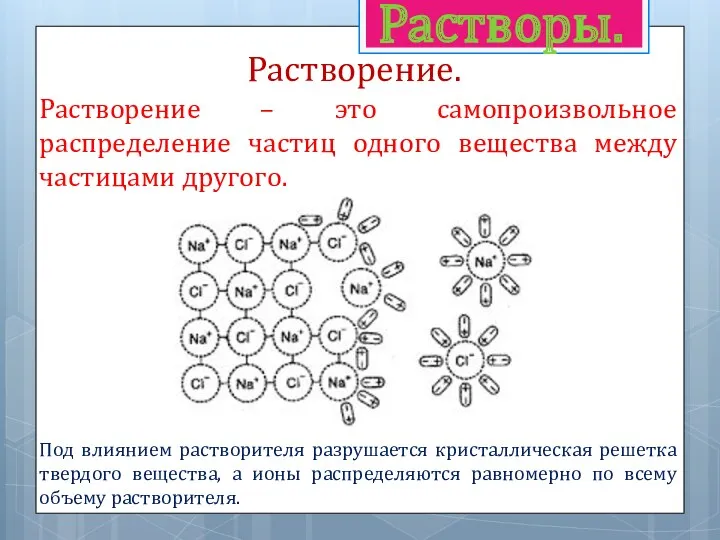
Растворы.
Растворимость.
Растворимость зависит от природы растворенного вещества и растворителя, а также от
внешних условий (температуры, давления).
Зависимость растворимости от природы растворенного вещества и растворителя
Растворимость твердых веществ в жидкостях зависит от типа связи в их кристаллических решетках. Например, вещества с атомными кристаллическими решетками (углерод, алмаз и др.) мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например, соли, кислоты, спирты хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20oС растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.












 Фенолы+
Фенолы+ Классификация химических реакций
Классификация химических реакций Механизмы органических реакций
Механизмы органических реакций Химия в повседневной жизни человека
Химия в повседневной жизни человека Водород
Водород Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Поширення металів у природі
Поширення металів у природі Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот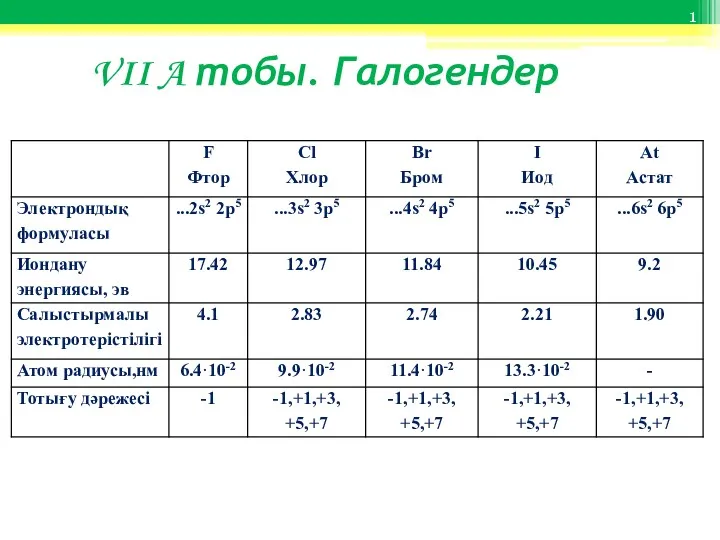 VII A тобы. Галогендер
VII A тобы. Галогендер Агрегатные состояния вещества
Агрегатные состояния вещества Технология производства бутилкаучука
Технология производства бутилкаучука Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Разделение углеводородных газов
Разделение углеводородных газов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Будова електронних оболонок атомів
Будова електронних оболонок атомів Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Значение органической химии в жизни человека
Значение органической химии в жизни человека Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Майлардың анықтамасы
Майлардың анықтамасы Харчові добавки
Харчові добавки Реакции ионного обмена
Реакции ионного обмена Хімічні властивості оксидів
Хімічні властивості оксидів Колоїдний захист
Колоїдний захист Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды