Содержание
- 2. Химическое равновесие Состояние равновесия характерно для обратимых химических реакций. Обратимая реакция - химическая реакция, которая при
- 4. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 5. Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
- 6. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит,
- 7. Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье). Принцип Ле-Шателье -Если на систему,находящуюся
- 8. Для одностадийной обратимой реакции при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют
- 9. Из условия равновесия V1=V2 следует: Отсюда получаем выражение для константы равновесия Kp: Чем выше величина Kp,
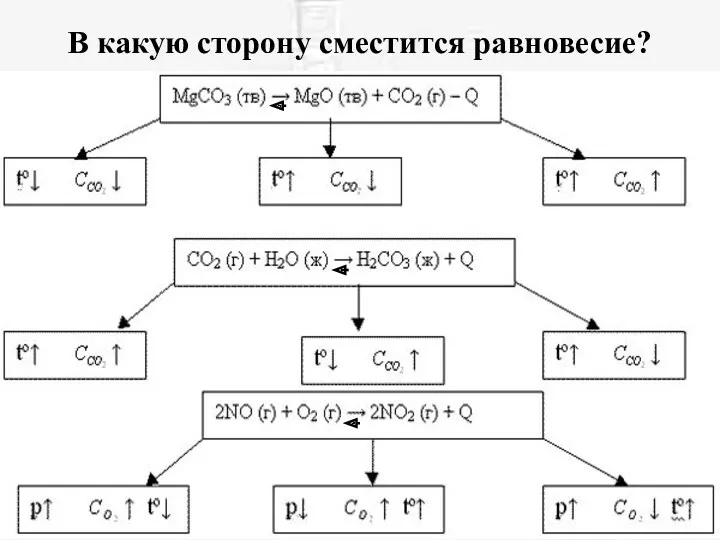
- 10. Влияние температуры на смещение равновесия Реакции, сопровождающиеся выделением теплоты, называются экзотермическими. Реакции, сопровождающиеся поглощением теплоты, называются
- 11. Влияние температуры на смещение равновесия Чтобы сместить равновесие вправо (для экзотермической реакции)---нужно понизить температуру. А для
- 12. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении
- 13. Влияние концентрации на смещение равновесия Равновесие сместится ВПРАВО, если: Увеличить концентрацию одного из реагирующих веществ Отводить
- 14. Влияние давления на смещение равновесия Влияние давления на состояние равновесия проявляется только при наличии в системе
- 15. Влияние давления на смещение равновесия При повышении давления равновесие сдвигается в направлении образования веществ (исходных или
- 16. N2 + 3H2 2NH3 + Q При повышении давления равновесие сместится туда, где молей меньше(где объемов
- 17. Катализаторы не влияют на положение равновесия!
- 18. В какую сторону сместится равновесие?
- 20. Скачать презентацию
















 Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Минеральные воды
Минеральные воды Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Материаловедение. Атомно-кристаллическое строение металлов и сплавов. (Тема 3)
Материаловедение. Атомно-кристаллическое строение металлов и сплавов. (Тема 3) Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1)
Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1) Свойства смесей ПАВ
Свойства смесей ПАВ Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Вода. Химические свойства воды. Состав, нахождение в природе
Вода. Химические свойства воды. Состав, нахождение в природе Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Хімічні властивості металів
Хімічні властивості металів Промышленная очистка воды
Промышленная очистка воды Окисно-відновні реакції. Хімія. 9 клас
Окисно-відновні реакції. Хімія. 9 клас Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Теория электролитической диссоциации
Теория электролитической диссоциации Узагальнення й систематизація знань з теми Початкові хімічні поняття
Узагальнення й систематизація знань з теми Початкові хімічні поняття Получение и применение спиртов
Получение и применение спиртов Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства
Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства Основные сведения о строении атома
Основные сведения о строении атома Переработка угля
Переработка угля Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Неметаллы: общая характеристика
Неметаллы: общая характеристика Расчеты, связанные с понятием доля
Расчеты, связанные с понятием доля Хімічні явища у природі
Хімічні явища у природі Твердые вещества
Твердые вещества большая стирка
большая стирка Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов