Слайд 2

Оксиды – это сложные вещества, которые состоят из двух элементов,
одним из которых является кислород.
Слайд 3

Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение.
Слайд 4

Цель урока:
повторить, углубить и обобщить знания о химических свойствах, получении и
применении основных и кислотных оксидов.
Слайд 5
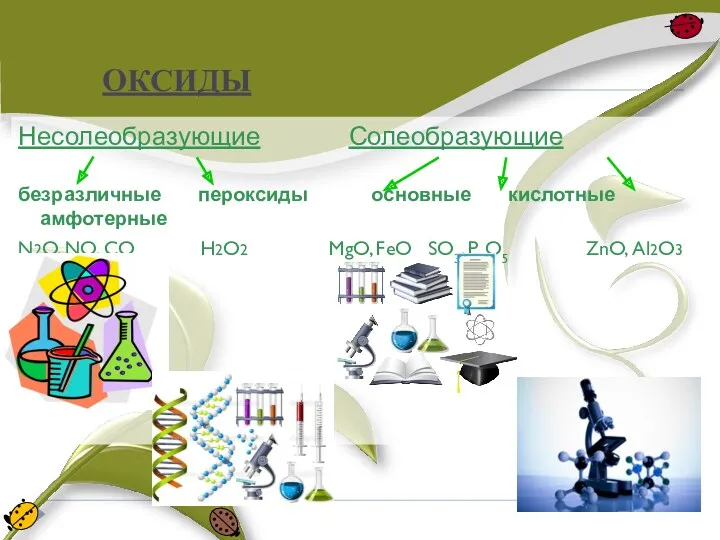
ОКСИДЫ
Несолеобразующие Солеобразующие
безразличные пероксиды основные кислотные амфотерные
N2O, NO, CO H2O2 MgO, FeO
SO3, P2O5 ZnO, Al2O3
BeO
Слайд 6
Слайд 7

Выполните задания:
Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl3,
K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO.
Слайд 8

2. Даны вещества:
CaO, NaOH, CO2,
H2SO3, CaCl2, FeCl3,
Zn(OH)2, N2O5,
Al2O3,
Ca(OH)2, CO2,
N2O, FeO,SO3, Na2SO4,
ZnO, CaCO3,
Mn2O7, CuO, KOH,
CO, Fe(OH)3
Выпишите оксиды и классифици-руйте их.
Слайд 9

Слайд 10

Физические свойства оксидов
При комнатной температуре
большинство оксидов - твердые вещества (СаО,
Fe2O3 и др.),
некоторые - жидкости (Н2О, Сl2О7 и др.)
и газы (NO, SO2 и др.).
Слайд 11

Химические свойства оксидов
Слайд 12

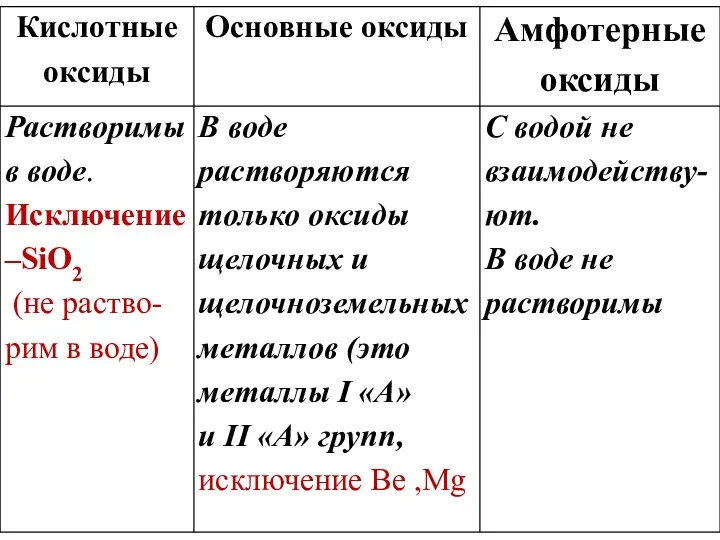
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
1. Кислотный оксид+ вода (р. соединения)
СO2 + H2O = H2CO3, SiO2 – не реагирует
2. Кислотный
оксид + Основание = Соль + Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
4. Менее летучие вытесняют более летучие из их солей
CaCO3 + SiO2 = CaSiO3 +CO2
Слайд 13

ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO +
2 HCl = ZnCl2 + H2O
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] ( в растворе)
ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении)
Слайд 14
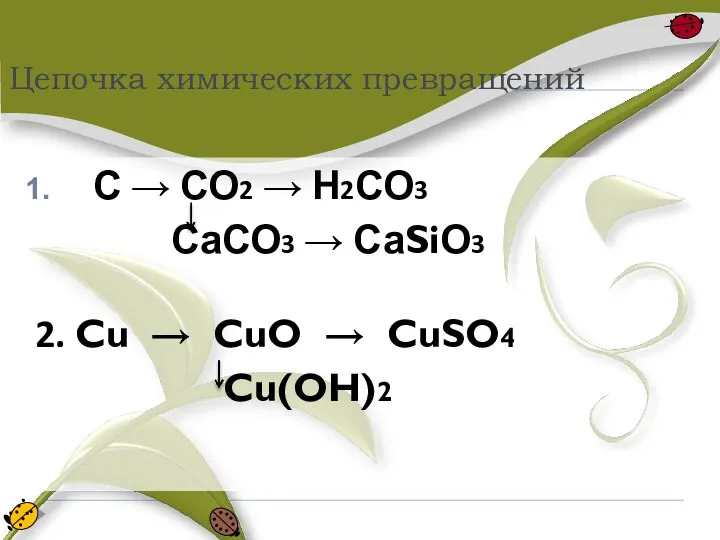
Цепочка химических превращений
С → СО2 → Н2СО3
СаСО3 → СаSiО3
2. Cu → CuO → CuSO4
Cu(OH)2













 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений