Содержание
- 4. Предельные углеводороды “Алканы”
- 6. 1. 1 Общая формула, название класса Алканы (предельные углеводороды, парафины) Алканы – алифатические (ациклические) предельные углеводороды,
- 7. Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода. Число
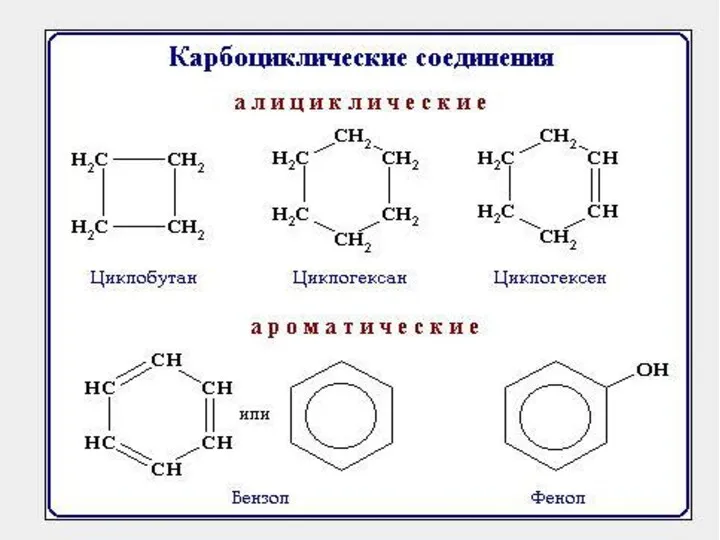
- 8. 1.2 Виды изомерии. Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но
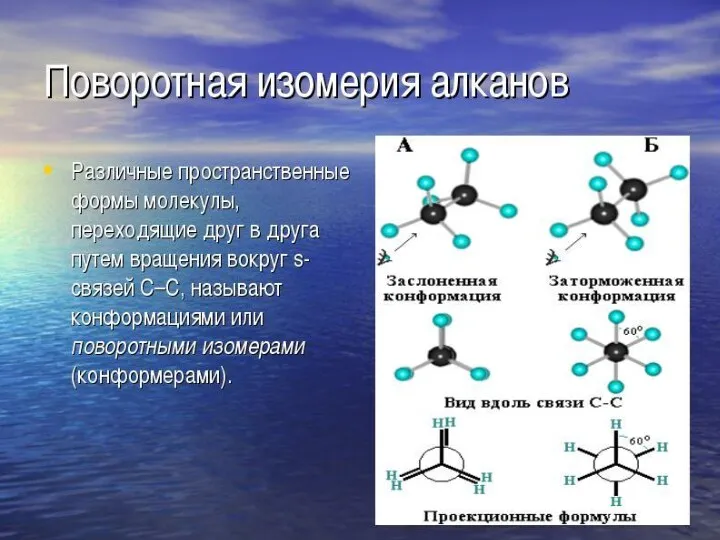
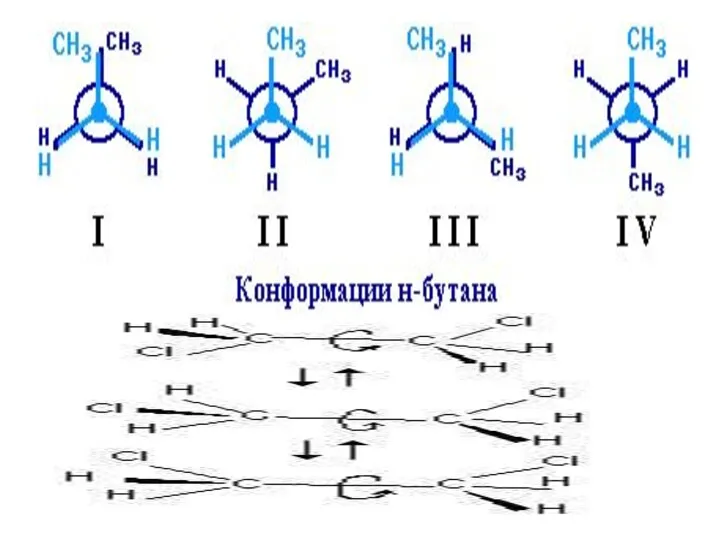
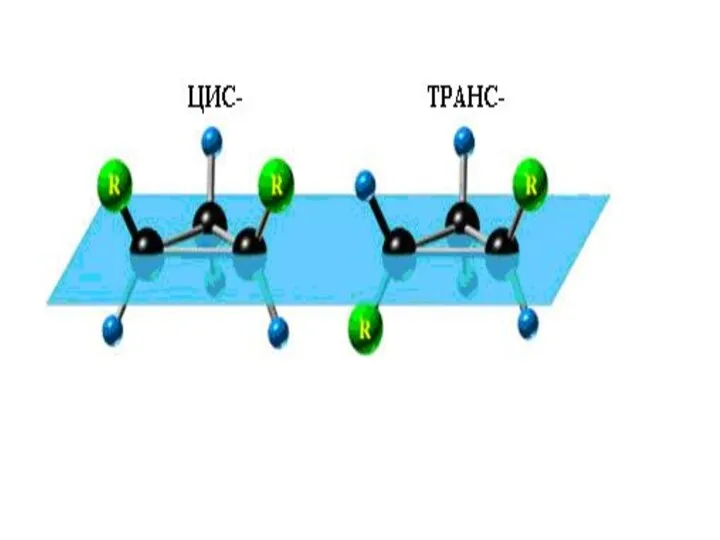
- 9. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве,
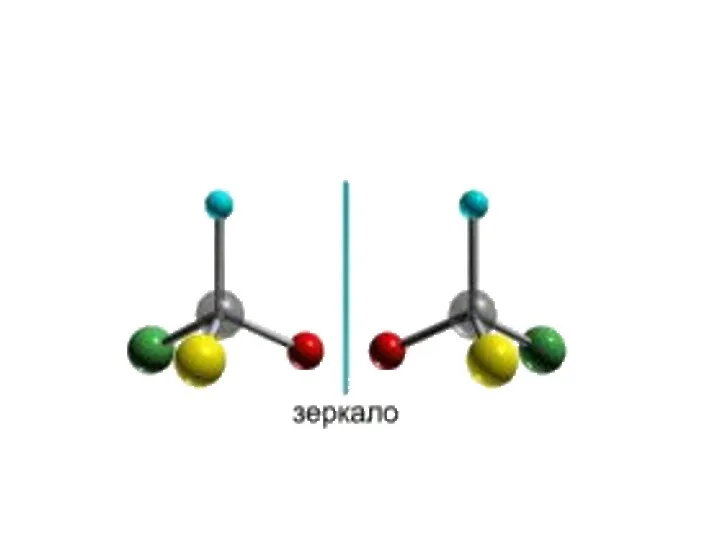
- 12. Кроме того, при наличии в молекуле атома углерода, связанного с 4-мя различными заместителями, возможен еще один
- 14. 1.4 Номенклатура. Номенклатура органических соединений – система правил, позволяющих дать однозначное название каждому индивидуальному веществу. Это
- 15. 1.3 Особенности электронного и пространственного строения. Химическое строение (порядок соединения атомов в молекулах) простейших алканов –
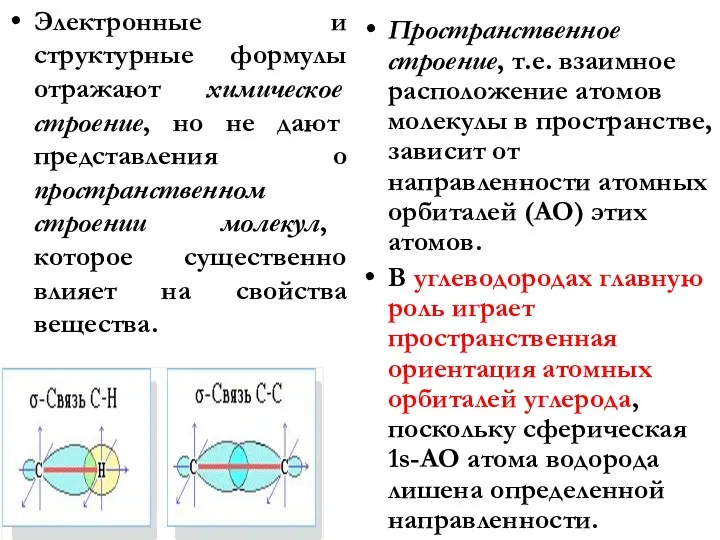
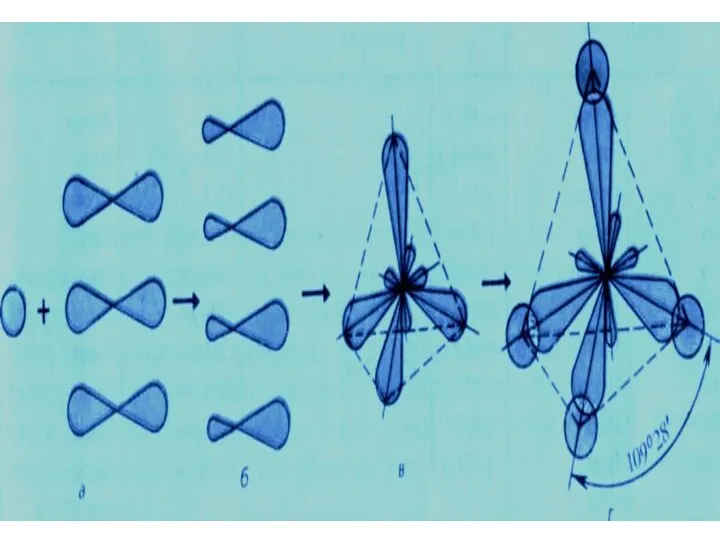
- 16. Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое
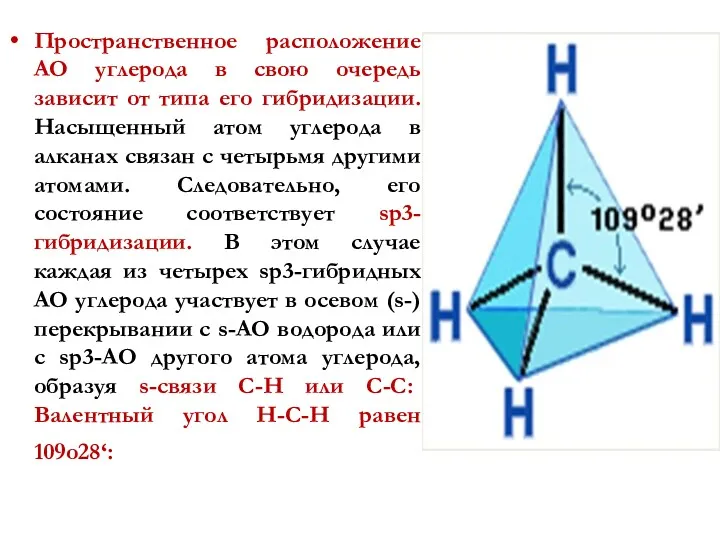
- 17. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в
- 19. Химические свойства любого соединения определяются его строением, т.е. природой входящих в его состав атомов и характером
- 20. Во-первых, предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения.
- 21. Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции
- 23. 1.6 Физические свойства. Физические свойства. Алканы - бесцветные вещества, нерастворимые в воде. В обычных условиях они
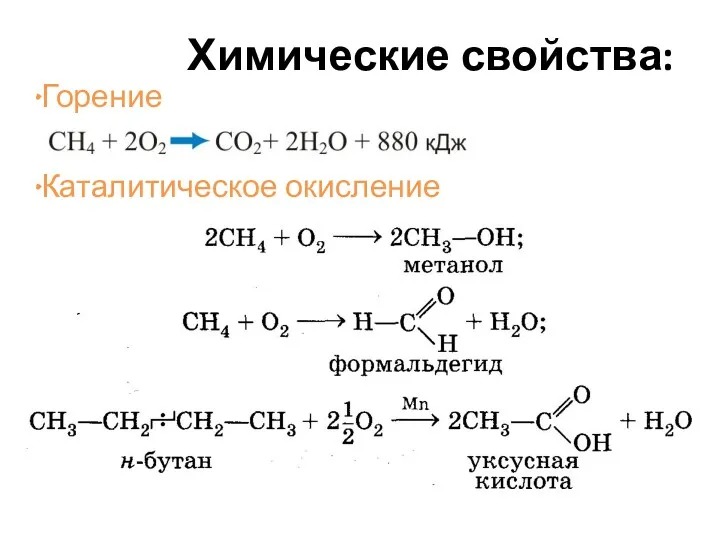
- 24. Химические свойства: Горение Каталитическое окисление
- 25. 1.7 Химические свойства. Тип Замещение Галогенирование. Для алканов характерны реакции замещения с галогенами, причем с фтором
- 26. Реакции замещения (по свободнорадикальному механизму) разрыв связей C – H и замещение атомов водорода Галогенирование Алканы
- 27. Механизм радикального замещенияSR Радикальные реакции имеют цепной механизм, включающий стадии: зарождение, развитие и обрыв цепи. Зарождение
- 28. SR Предельные углеводороды вступают в реакции нитрования, сульфирования, сульфохлорирования и сульфоокисления углеводородов: RH + НО-NO2 =
- 29. Химические свойства: Нитрование (Реакция Коновалова) В первую очередь замещаются атомы водорода у III > II >
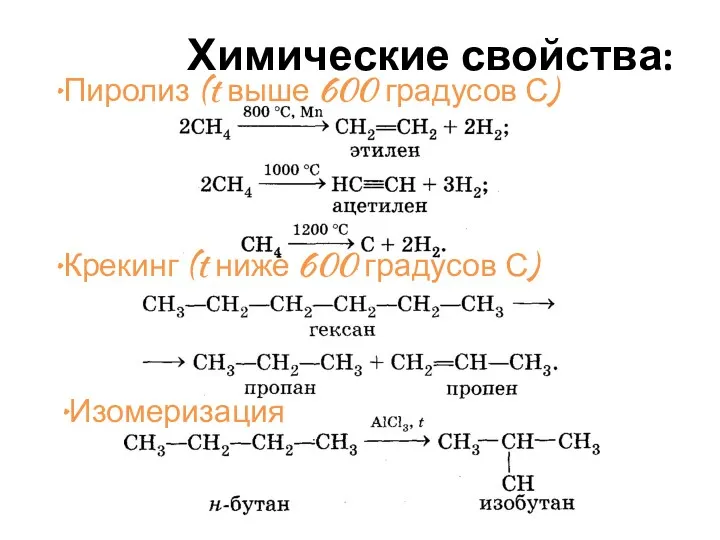
- 30. Химические свойства: Пиролиз (t выше 600 градусов С) Крекинг (t ниже 600 градусов С) Изомеризация
- 31. 1.5 Способы получения. Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются
- 32. 2. Синтез более сложных алканов из галогенопpоизводных с меньшим числом атомов углеpода: 3.Из солей карбоновых кислот:
- 33. 1.5 Способы получения. 5. Гидрирование непредельных углеводородов: 6. Газификация твердого топлива (при повышенной температуре и давлении,
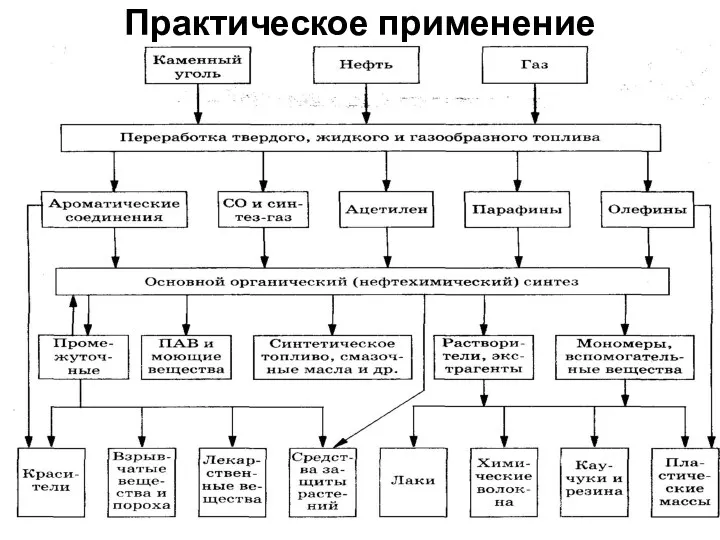
- 34. Практическое применение
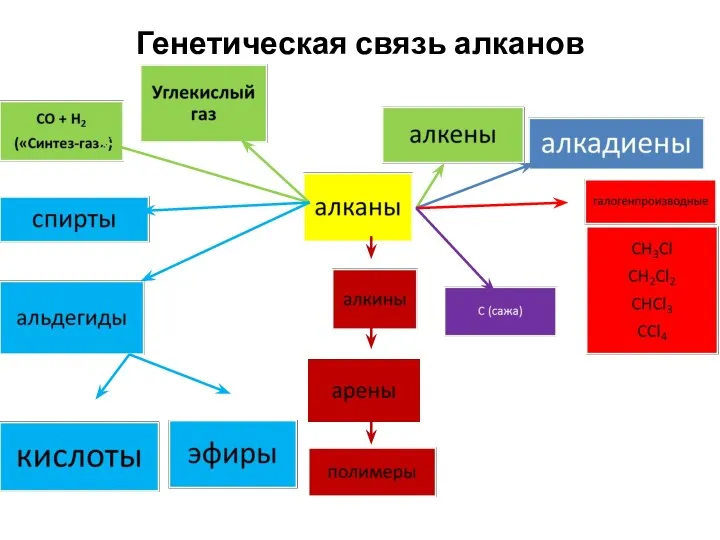
- 35. Генетическая связь алканов
- 36. Генетическая связь алканов Решить превращение 38(ЕГЭ)
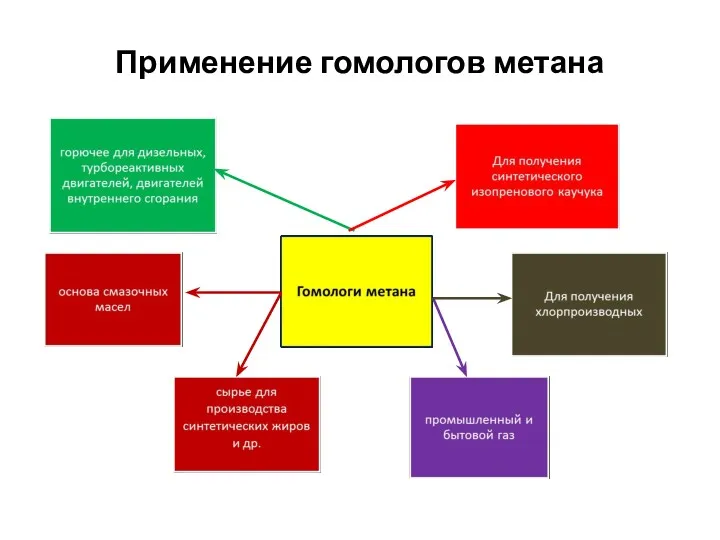
- 37. Применение гомологов метана
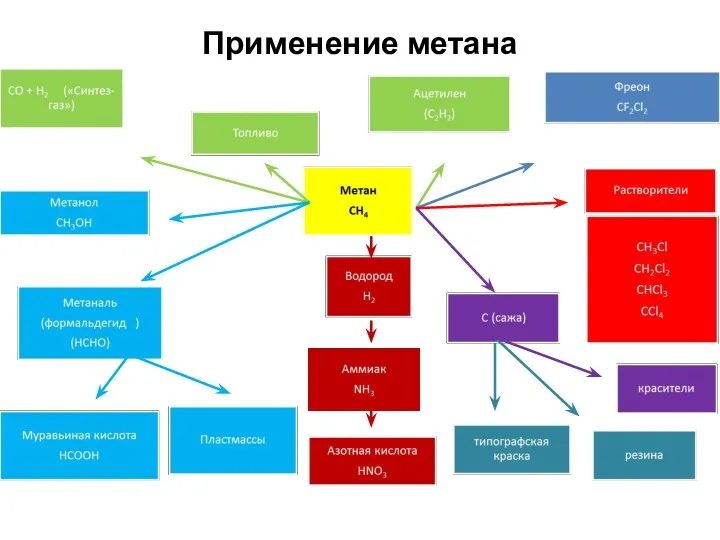
- 38. Применение метана
- 40. Скачать презентацию





















 Хром
Хром Металлы. Лекция № 9
Металлы. Лекция № 9 Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Защитные материалы
Защитные материалы Магнитные наночастицы: проблемы и достижения
Магнитные наночастицы: проблемы и достижения Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Общая характеристика неметаллов
Общая характеристика неметаллов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Оксиды. Понятия об оксидах
Оксиды. Понятия об оксидах Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Алюминий и его соединения
Алюминий и его соединения Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Химическое равновесие
Химическое равновесие d997-13229e5e
d997-13229e5e Типы химических реакций
Типы химических реакций Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Соли аммония
Соли аммония Минералогический состав почв
Минералогический состав почв Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Азотсодержащие органические соединения
Азотсодержащие органические соединения История развитии химии
История развитии химии Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Аллотропные модификации кремния
Аллотропные модификации кремния