Содержание
- 2. Общие свойства металлов обусловлены: - Строением атома - Наличием кристаллической решетки - Наличием металлической связи
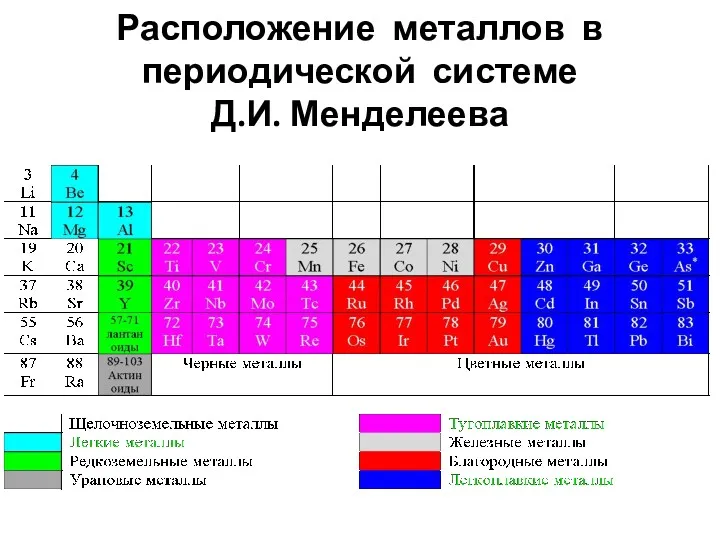
- 3. Расположение металлов в периодической системе Д.И. Менделеева
- 4. s-металлы: элементы IA и IIA групп. Свойства s-металлов: – постоянные валентности или степени окисления (+1 и
- 5. p-металлы: элементы IIIA (кроме бора B), IVA (германий Ge, олово Sn, свинец Pb) и VA (сурьма
- 6. d-металлы: 30 элементов, расположенных в серединах периодов (IV, V, VI, VII) и достраивающих d-подуровень предпоследнего слоя
- 7. f-металлы: лантаноиды и актиноиды. У этих элементов достраиваются энергетические подуровни 4f и 5f при заполненном внешнем
- 8. Черные металлы Черные металлы характеризуются темно-серым цветом, большой плотностью (кроме щелочноземельных Ме), высокой температурой плавления, относительно
- 9. Черные подразделяются: Железные металлы - Fe, Co, Ni (ферромагнетики) и Mn. Тугоплавкие металлы - температура плавления
- 10. Цветные металлы Цветные металлы характеризуются: характерной окраской (красная, желтая, белая), большой пластичностью, низкой температурой плавления, отсутствием
- 11. Цветные подразделяются: Легкие металлы - Be, Mg, Al - малая плотность. Благородные металлы - Ag, Au,
- 12. Нахождение металлов в природе В самородном состоянии: Cu, Ag, Hg, Pt, Au В виде соединений: оксидные
- 13. Кристаллические структуры металлов 1. Объемноцентрированная кубическая решетка (ОЦК) (Na, K, α-Fe, δ-Fe, V, Cr, Mo, W)
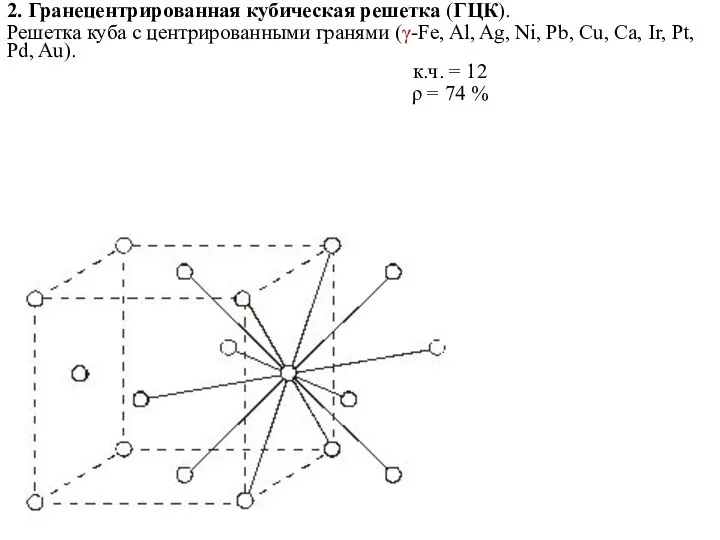
- 14. 2. Гранецентрированная кубическая решетка (ГЦК). Решетка куба с центрированными гранями (γ-Fe, Al, Ag, Ni, Pb, Cu,
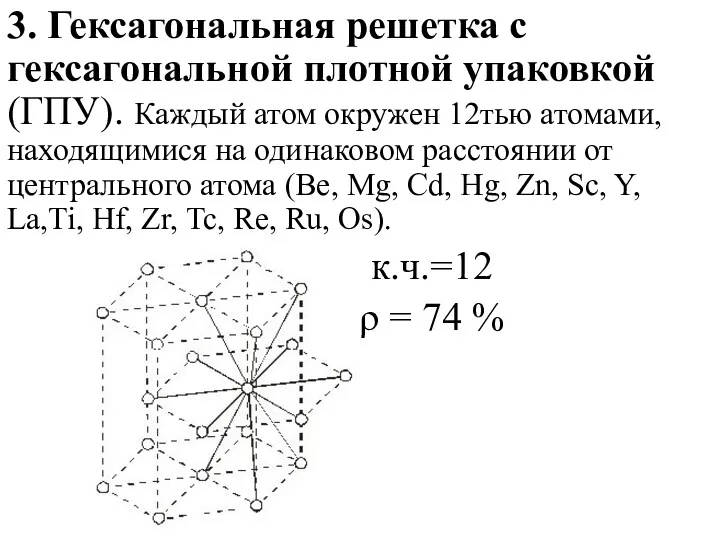
- 15. 3. Гексагональная решетка с гексагональной плотной упаковкой (ГПУ). Каждый атом окружен 12тью атомами, находящимися на одинаковом
- 16. Полиморфизм α – модификация устойчива при сравнительно низких температурах, β – устойчива при более высоких температурах.
- 17. Физические свойства металлов 1. Твердость (кроме Hg) Самый твердый Cr. Самые мягкие – щелочные. 3. Температура
- 18. 4. Плотность От 0,53 Li до 22,5 г/см3 Os ρ ρ > 5 г/см3 – тяжелые
- 19. 6. Магнитные свойства a) Диамагнитные (в основном амфотерные Ме: Be,Zn,Ga,Ge) б) Парамагнитные в) Ферромагнитные (Fe, Co,
- 20. Получение металлов Пирометаллургия Восстановители: уголь, оксида углерода (II) или водород. — С или СО ZnО +
- 21. — Сульфидные руды 2ZnS + 3О2 = 2ZnО + 2SО2 ZnО + С = СО +
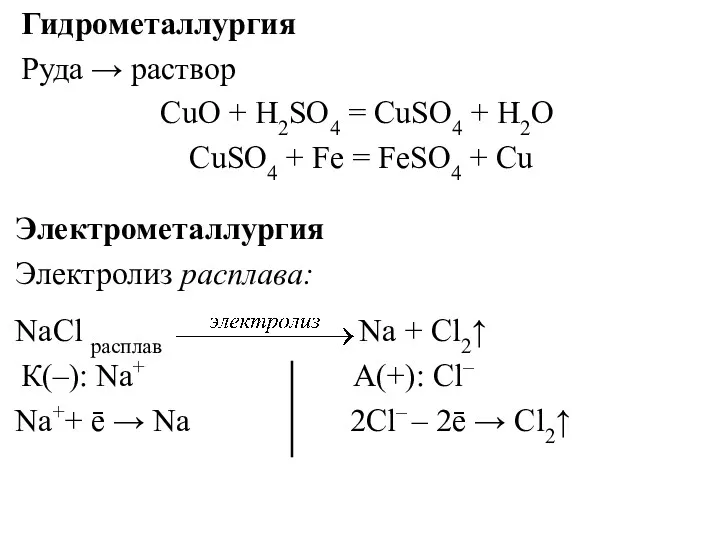
- 22. Гидрометаллургия Руда → раствор CuO + Н2SО4 = CuSО4 + Н2О CuSО4 + Fe = FeSO4
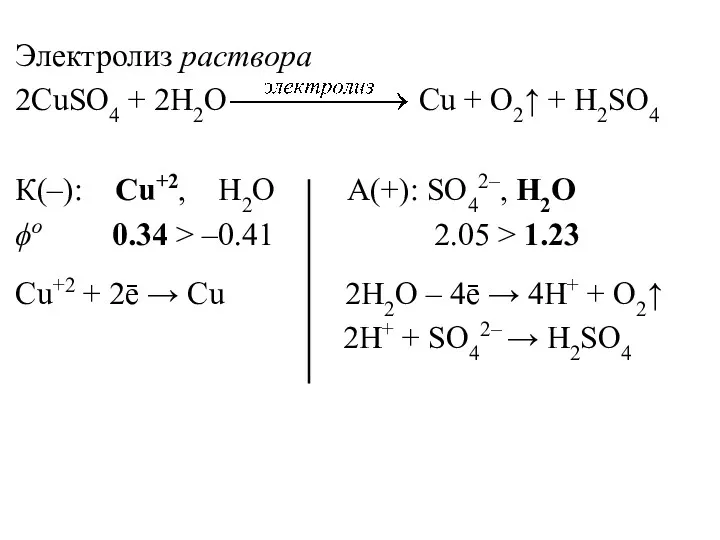
- 23. Электролиз раствора 2CuSO4 + 2H2O Cu + O2↑ + H2SO4 К(–): Cu+2, H2O А(+): SO42–, H2O
- 24. ПОЛУЧЕНИЕ МЕТАЛЛОВ ВЫСОКОЙ ЧИСТОТЫ 1. Электролитическое рафинирование (Ag, Cu, Fe, Ni, Pb) 2. Перегонка и переплавка
- 25. 3. Химические транспортные реакции Карбонильный способ (Ni, Fe) Ni + 4CO Ni(CO)4 (t = 42°C) тетракарбонил
- 26. 4. Зонная плавка (Ge, W, Mo) до чистоты 10-8 %
- 27. ХИМИЧЕСКИЕ СВОЙСТВА Me ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ С кислородом. Все, кроме Pt, Pd, Au. 4Li +
- 28. С водородом. Взаимодействуют щел. и щел.-зем. металлы: Ca (Sr, Ba) + H2 = CaH2 (SrH2, BaH2)
- 29. С серой. 2Ag + S = Ag2S2- сульфид серебра С галогенами. Mg + Cl2 = MgCl21-
- 30. С другими неметаллами. Из металлов I группы с азотом, углеродом, кремнием непосредственно взаимодействует только литий: 6Li
- 31. 2. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ С водой. Металлы I группы: Na + H2O = NaOH +
- 32. 2) C кислотами. Все металлы, расположенные в ряду напряжений до водорода вытесняют его из разбавленных кислот,
- 33. 3) Со щелочами. Взаимодействуют амфотерные металлы (Zn, Al, Pb, Sn, Be, Cr(III)). Zn + 2NaOH +
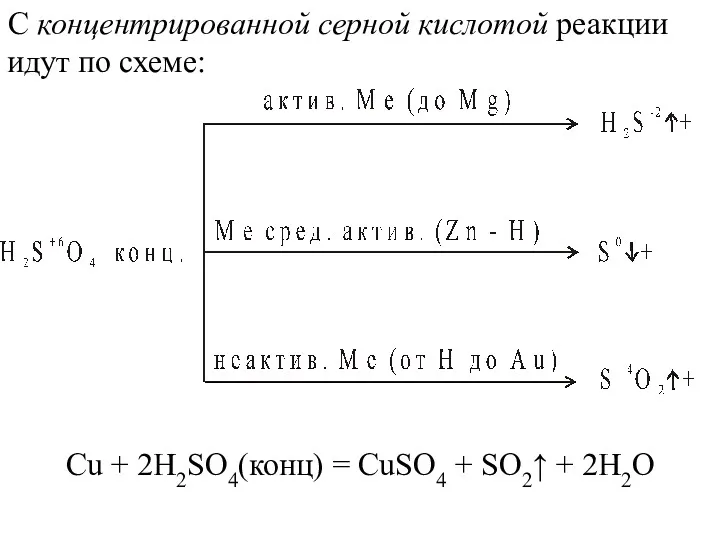
- 34. С концентрированной серной кислотой реакции идут по схеме: Сu + 2Н2SO4(конц) = СuSO4 + SO2↑ +
- 36. Скачать презентацию



























 Дендример, или арборол
Дендример, или арборол Липиды и обмен липидов
Липиды и обмен липидов Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Галогени. Знаходження в природі
Галогени. Знаходження в природі Реакции ионного обмена
Реакции ионного обмена Алкодиены или диеновые углеводороды
Алкодиены или диеновые углеводороды Теплота горения
Теплота горения Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Кислоты. Серная кислота-H₂SO₄
Кислоты. Серная кислота-H₂SO₄ Фосфор. 9 класс
Фосфор. 9 класс Нитраттарды қолдану
Нитраттарды қолдану Магний (Mg)
Магний (Mg) Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Химическое кафе Кислоты
Химическое кафе Кислоты Соединения углерода
Соединения углерода Жиры и мыло
Жиры и мыло топ през
топ през Мир кристаллов. Изучение теоретического материала по теме Кристалл
Мир кристаллов. Изучение теоретического материала по теме Кристалл Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Механизмы органических реакций
Механизмы органических реакций Количество вещества. 8 класс
Количество вещества. 8 класс Гомологический ряд алканов. Изомерия и номенклатура
Гомологический ряд алканов. Изомерия и номенклатура Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Катализаторы. Ферменты
Катализаторы. Ферменты Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні