Содержание
- 2. Внимание! Задания по типу «ЕГЭ»
- 3. Внимание! Задания по типу «ЕГЭ» Задача 1. Неизвестный алкан, объемом 33,6 мл (н.у.), сожгли в избытке
- 4. Для того, чтобы решить задания Вспомним физические свойства алканов. Повторим химические свойства алканов. Проанализируем способы получения
- 5. 1. Физические свойства алканов Алканы (предельные, насыщенные углеводороды) – углеводороды с открытой углеродной цепью, в молекулах
- 6. Понятие о гомологии и изомерии Гомологи – вещества, сходные по строению и свойствам, отличающиеся на гомологическую
- 7. 2. Получение алканов Получение в промышленности 1. Получение из природного сырья (нефти, природных и попутных газов).
- 8. 2. Получение алканов (а) Получение в лаборатории 1. Разложение карбида алюминия (получение метана) 2. Декарбоксилирование солей
- 9. 2. Получение алканов (б) Получение в лаборатории 4. Каталитическое гидрирование (присоединение водорода) 5. Реакция Вюрца (алканы
- 10. 2. Получение алканов (в) Получение в лаборатории 7. Восстановление производных алканов 8. Получение алканов разветвленного строения
- 11. 3. Химические свойства (а) В данной презентации рассматриваются только те свойства, которые выделены красным цветом. На
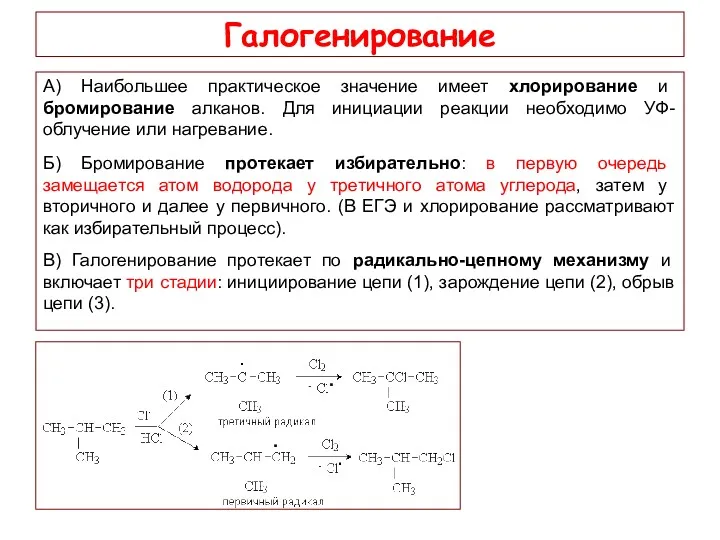
- 12. Галогенирование А) Наибольшее практическое значение имеет хлорирование и бромирование алканов. Для инициации реакции необходимо УФ-облучение или
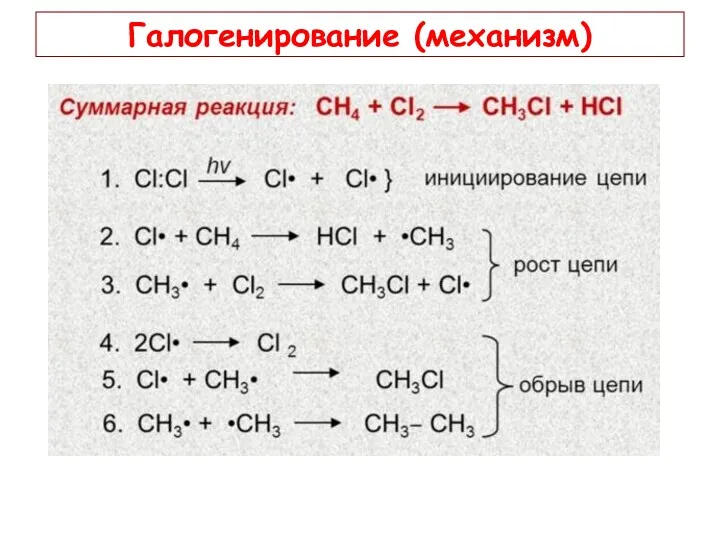
- 13. Галогенирование (механизм)
- 14. Нитрование А) Впервые реакцию нитрования алканов провел М.И. Коновалов в 1888 г, действуя на алканы разбавленной
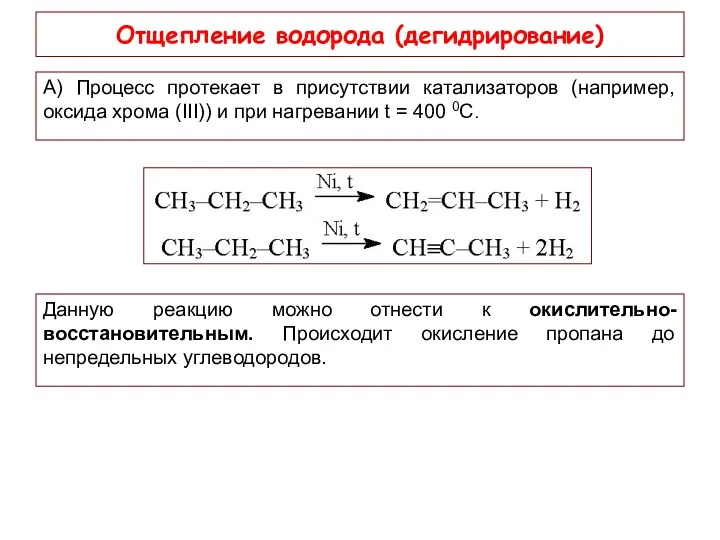
- 15. Отщепление водорода (дегидрирование) А) Процесс протекает в присутствии катализаторов (например, оксида хрома (III)) и при нагревании
- 16. Окисление алканов (горение) -3 0 +4 -2 2С2Н6 + 7О2 = 4СО2 + 6Н2О -3 +4
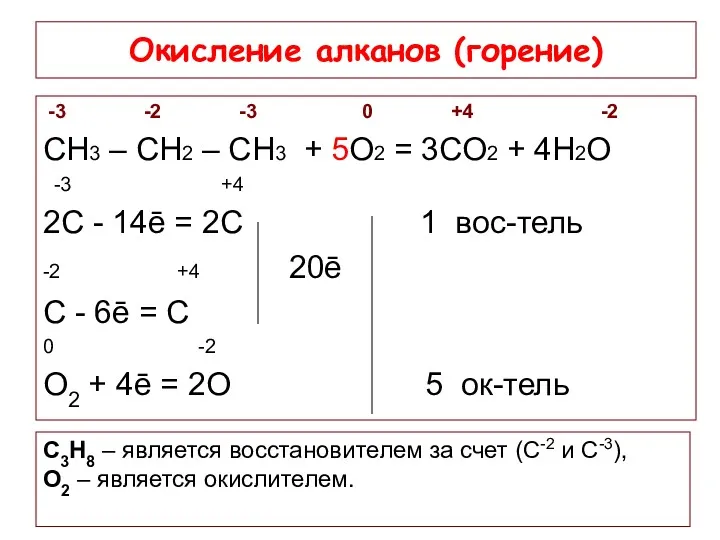
- 17. Окисление алканов (горение) -3 -2 -3 0 +4 -2 СН3 – СН2 – СН3 + 5О2
- 18. Цепочка №1 (генетическая связь)
- 19. Цепочка №2 (генетическая связь) Спиртовой р-р
- 20. Цепочка №3 (генетическая связь)
- 21. Решение задачи Ответ: СxHy – метилпропан (С4Н10)
- 22. Спасибо за внимание! Материал тренировочной презентации НЕ является исчерпывающим и позволяет рассмотреть очень кратко только некоторые
- 24. Скачать презентацию

















 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов