Слайд 2

Таблица. Свойства галогенов.
Слайд 3

Галогены в природе.
Галогены в природе находятся только в виде соединений, причем
в состав
этих
соединений галогены входят (за редчайшим исключением) только в
степени
окисления -1.
Слайд 4
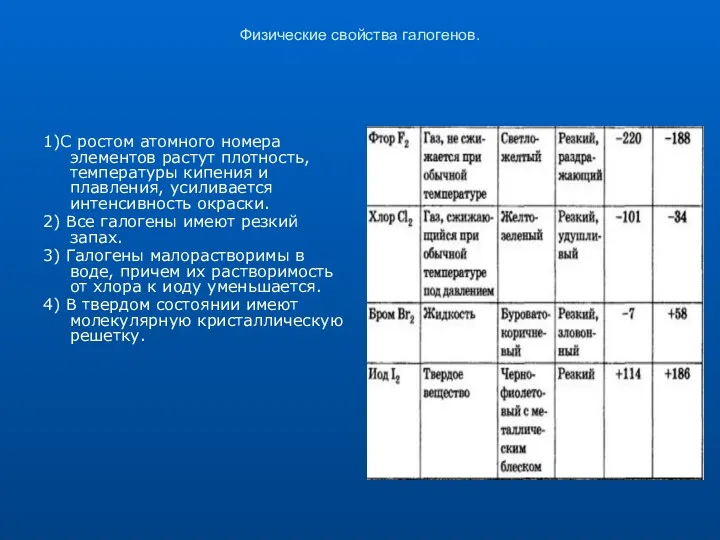
Физические свойства галогенов.
1)С ростом атомного номера элементов растут плотность, температуры кипения
и плавления, усиливается интенсивность окраски.
2) Все галогены имеют резкий запах.
3) Галогены малорастворимы в воде, причем их растворимость от хлора к иоду уменьшается.
4) В твердом состоянии имеют молекулярную кристаллическую решетку.
Слайд 5

Химические свойства галогенов.
1) Атомы галогенов на внешнем энергетическом уровне имеют 7
электронов. Легко присоединяют недостающий один электрон и проявляют окислительные свойства.
2) Галогены – типичные окислители и неметаллы. Фтор – самый активный неметалл и самый сильный окислитель, т.к. его атом имеет наименьший радиус среди атомов галогенов.
3) Галогены имеют отрицательную степень окисления –1, проявляют ее в соединениях с водородом и металлами.
4) Ионы галогенов Г– способны только отдавать электроны, поэтому являются восстановителями.
5) С водородом галогены образуют летучие водородные соединения HГ, которые хорошо растворяются в воде.
6) Устойчивость галогеноводородов от HF к HI уменьшается.
7) Восстановительная активность атомов галогенов в степени окисления –1 (Г) увеличивается в ряду:
-1 -1 -1 -1
F Cl Br I
Слайд 6

Получение галогенов.
1)Важнейший способ получения фтора — электролиз расплавов фторидов, где фтор
выделяется на аноде:2F--2e-F2
В качестве основного источника получения используется гидрофторид KHF2.
2) Хлор в лабораторных условиях получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV). Реакция прорекает при нагревании.
4HСl-1+Mn+4O2=Сl02+Mn+2Сl2+2Н2O
3)Для получения брома чаще применяют реакцию замещения его в бромидах. 2KBr+Сl2=2KСl+Br2
4) Основные источники получения йода — это морские водоросли и нефтяные буровые воды.
2NaI+MnO2+3H2SO4=I2+2NaHSO4+MnSO4+2Н2О Получение йода из его природных источников сводится к переводу его в молекулярный:
2NaI+2NaNO2+2H2SO4=I2+2H2O+2NO+2Na2SO4
Слайд 7

Применение галогенов.
Галогены используются в химической промышленности, для очистки воды
и
отходов, в производстве пластмасс, фармацевтических препаратов,
целлюлозы и бумаги, тканей, смазочных материалов. Бром, хлор,
фтор и йод служат химическими промежуточными звеньями,
отбеливающими и дезинфицирующими средствами. Бром и хлор
применяются в текстильной промышленности для отбеливания и
предотвращения усадки шерсти. Бром также используется в процессах
экстракции золота и при бурении нефтяных и газовых скважин. Он
Применяется как антипирен в производстве пластмасс и как
промежуточное звено в производстве гидравлических жидкостей,
хладагентов, влагопоглотителей и средств для завивки волос. Бром входит
в состав боевых отравляющих газов и огнегасящих жидкостей.






 Органическая химия
Органическая химия Растворение. Растворимость веществ в воде. Классификация растворов
Растворение. Растворимость веществ в воде. Классификация растворов Железо и его соединения
Железо и его соединения Хімічні властивості алканів
Хімічні властивості алканів Щелочные породы среднего состава
Щелочные породы среднего состава Применение уксусной кислоты
Применение уксусной кислоты Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність Чипсы: вред или польза
Чипсы: вред или польза Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Металлы – простые вещества
Металлы – простые вещества Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Теплота сгорания топлива
Теплота сгорания топлива 20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx
20230316_otkrytyy_urok_v_8_kl_geneticheskaya_svyaz.docx Электролитическая диссоциация
Электролитическая диссоциация Характеристика неметаллов. Галогены
Характеристика неметаллов. Галогены Оксиды серы. Сернистая кислота
Оксиды серы. Сернистая кислота Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Степень окисления
Степень окисления Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Аммиак. 9 класс
Аммиак. 9 класс Поверхностные явления
Поверхностные явления Тайна мыльного пузыря
Тайна мыльного пузыря Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Современные проблемы химической технологии вяжущих материалов
Современные проблемы химической технологии вяжущих материалов