Содержание
- 2. Мета уроку: Ознайомитись з хімічними властивостями метану та його гомологів; навчитись складати відповідні рівняння реакцій; установити
- 3. Експрес-контроль Найпростіша органічна речовина – це… Загальна формула алканів – … Гомологи – це речовини, які
- 4. Відповіді на завдання: …метан. …СnH2n+2. …мають подібну будову, але різняться за складом на одну або декілька
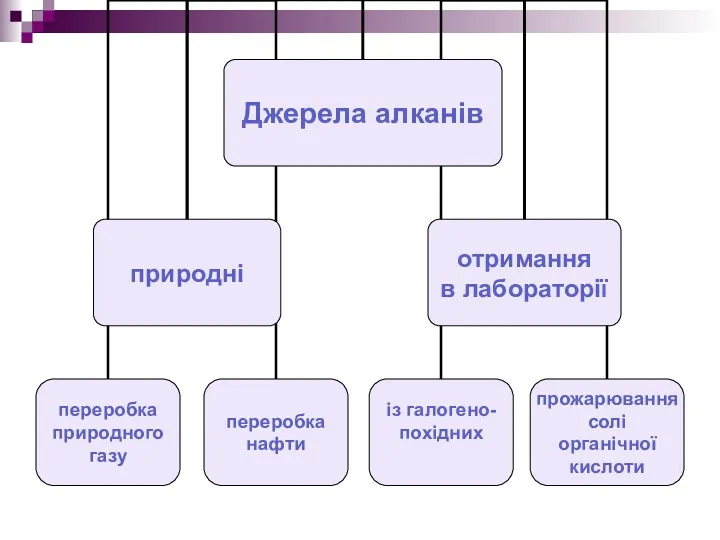
- 5. Хімічні властивості алканів Алкани хімічно неактивні речовини, завдяки цьому їх називають парафінами. Алкани не взаємодіють із
- 6. Алкани – неактивні речовини
- 7. Взаємодія з киснем Алкани дуже добре взаємодіють з киснем. Метан при підпалюванні згоряє блідо-синім полум'ям, погано
- 8. Небезпечна суміш Суміші метану з повітрям (10% метану) – вибухонебезпечні. При використанні газових плит необхідно постійно
- 9. Окиснення гомологів метану Повне окиснення до вуглекислого газу відбувається тільки при горінні в надлишку кисню: 2С6Н14
- 10. Горіння вищих алканів Алкани з високим числом атомів Карбону при горінні можуть утворювати вуглець. Побутові свічки,
- 11. Горіння парафіну, визначення якісного складу продуктів горіння
- 12. Взаємодія з галогенами Реакція заміщення з галогенами називається галогенуванням. Взаємодія алканів із хлором або бромом відбувається
- 13. Взаємодія з галогенами У випадку надлишку галогену можуть заміщуватися декілька атомів Гідрогену: СН4 + 3Cl2 →
- 14. Назви утворених продуктів Назви утворених продуктів походять від назв алканів. CH3Cl – хлорметан. CHCl3 – трихлорметан
- 15. Термічний розклад При сильному нагріванні (понад 1000оС) алкани розкладаються з утворенням вуглецю і водню:
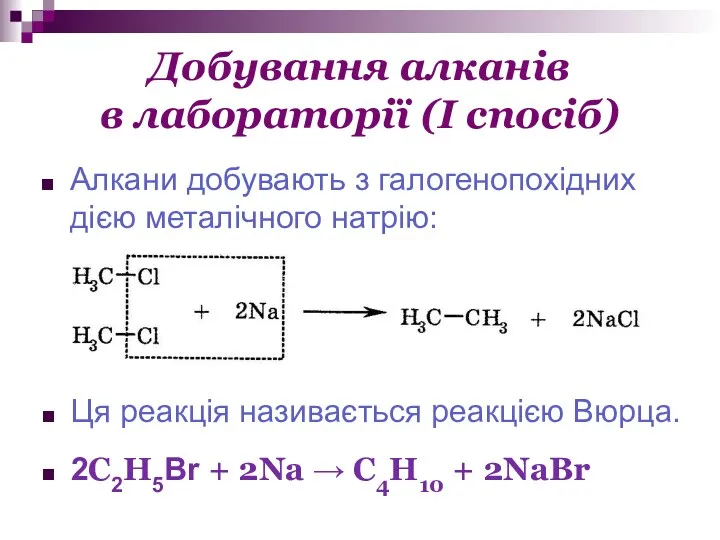
- 17. Добування алканів в лабораторії (І спосіб) Алкани добувають з галогенопохідних дією металічного натрію: Ця реакція називається
- 18. Добування алканів в лабораторії (ІІ спосіб) Алкани добувають прожарюванням солі органічної (карбонової) кислоти у присутності лугів:
- 19. Завдання на закріплення знань: 1. Напишіть рівняння реакції горіння а) пропану; б) пентану. 2. Напишіть рівняння
- 20. Відповіді на завдання: 1. а) C3H8 + 5O2 → 3CO2 + 4H2O б) C5H12 + 8O2
- 22. Скачать презентацию

















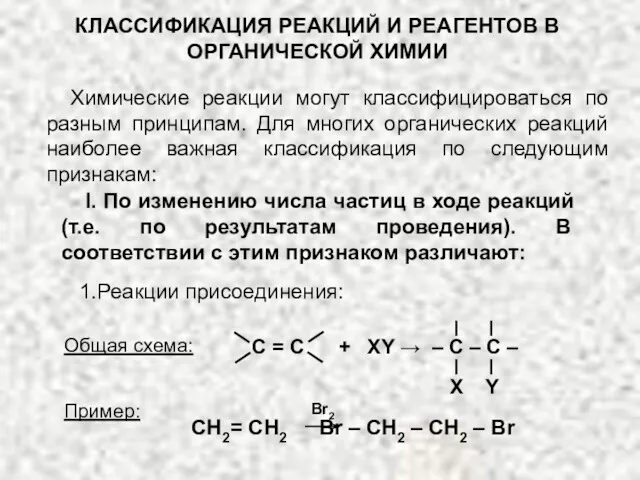 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Электролитическая диссоциация
Электролитическая диссоциация Соединения галогенов
Соединения галогенов Типы химических реакций
Типы химических реакций Происхождение химических элементов
Происхождение химических элементов Строение вещества. Строение атома и периодическая система элементов
Строение вещества. Строение атома и периодическая система элементов Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Метод изготовления слоистых и намотанных ПКМ
Метод изготовления слоистых и намотанных ПКМ Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Опасности среды обитания человека
Опасности среды обитания человека Химическая лаборатрия. Химический состав растений
Химическая лаборатрия. Химический состав растений Третья группа, главная подгруппа. 9 класс
Третья группа, главная подгруппа. 9 класс Химический состав нефтей. Циклические соединения
Химический состав нефтей. Циклические соединения Изомерия
Изомерия Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Растительные индикаторы
Растительные индикаторы Структура легированной стали
Структура легированной стали Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Полусинтетическое масло
Полусинтетическое масло Бензол. Чикишев С. (2)
Бензол. Чикишев С. (2) Химия - тұрмыста
Химия - тұрмыста Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства