Содержание
- 2. План: Скорость химической реакции Гетерогенные и гомогенные реакции Зависимость скорости реакции от различных факторов: Природа реагирующих
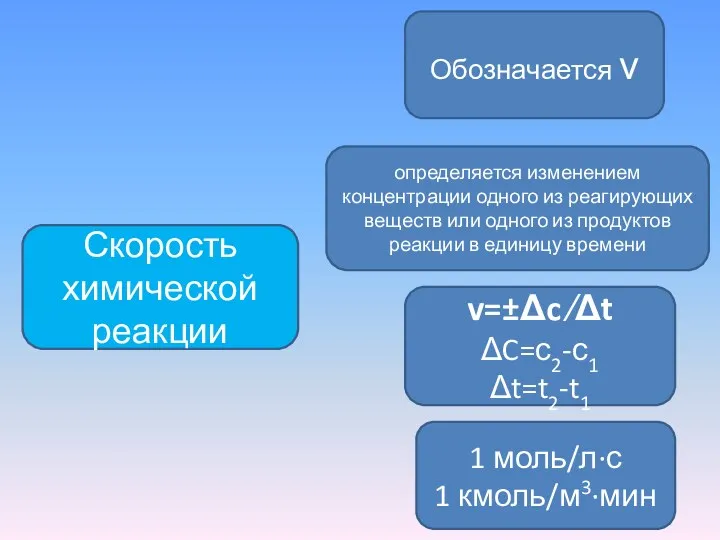
- 3. Скорость химической реакции Обозначается ν 1 моль/л∙с 1 кмоль/м3∙мин определяется изменением концентрации одного из реагирующих веществ
- 4. Раздел химии, изучающий скорость химической реакции, называется химической кинетикой.
- 5. Гетерогенные реакции Это реакции идущие между веществами в неоднородной среде. Например, на поверхности соприкосновения твердого вещества
- 6. Гомогенные реакции Это реакции протекающие в однородной среде(нет поверхности раздела реагирующих веществ). Например в смеси газов
- 7. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; концентрация реагирующих веществ поверхность соприкосновения реагирующих веществ
- 8. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 9. Теория столкновений. Основная идея теории: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем
- 10. 2. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 11. Закон действующих масс. Гульдберг (1836-1902). Норвежский физикохимик. П. Вааге (1833-1900). Норвежский ученый. V=kcAacBb Скорость химической реакции
- 12. 3.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
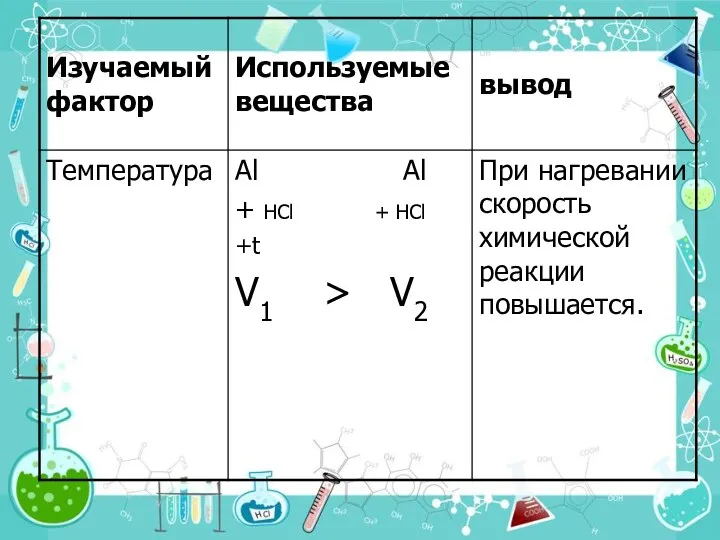
- 14. 4. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 15. Правило Вант-Гоффа Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и стереохимии При
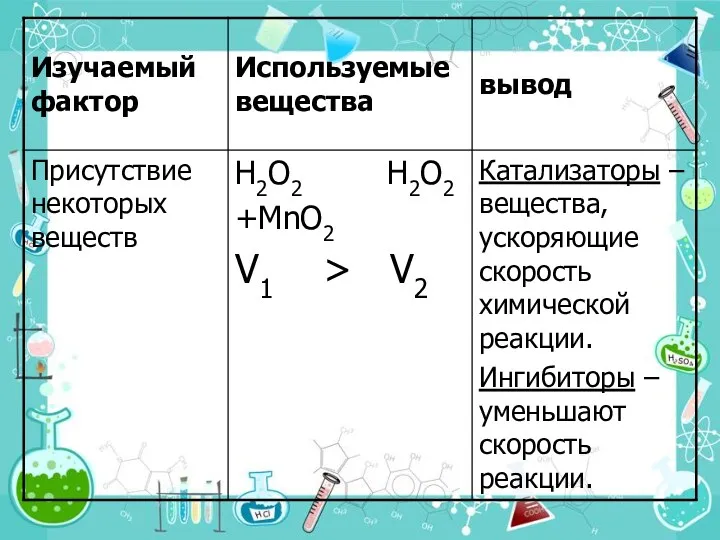
- 17. 5. Действие катализатора Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют
- 18. Различают два вида катализа: Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном
- 20. Выводы по теме: «Скорость химических реакций» Химические реакции протекают с различными скоростями. Величина скорости реакции зависит
- 21. Алгоритм решения задач по теме "Скорость химической реакции" Задача №1 Реакция протекает по уравнению А+В =
- 22. Задача №2 Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70
- 24. Скачать презентацию


















 Железо как химический элемент
Железо как химический элемент Химические реакторы
Химические реакторы Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях
Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях Термохімічні рівняння
Термохімічні рівняння Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Фракционная перегонка нефти
Фракционная перегонка нефти Химия. D-элементтер
Химия. D-элементтер Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Застосуванння електролiзу
Застосуванння електролiзу Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Углекислый газ
Углекислый газ Изомеры и гомологи
Изомеры и гомологи Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях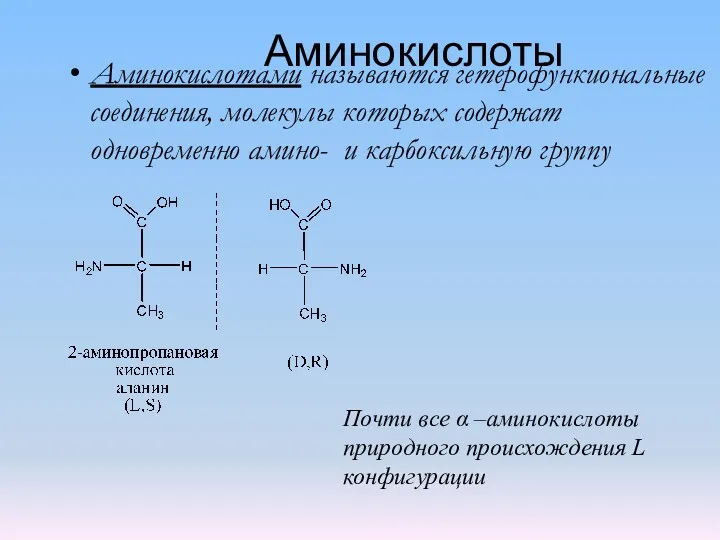 Аминокислоты 1
Аминокислоты 1 Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Мембранное материаловедение
Мембранное материаловедение Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Химические свойства металлов
Химические свойства металлов Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Амин қышқылдар
Амин қышқылдар Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Обезвреживающая функция печени
Обезвреживающая функция печени Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота