Содержание
- 2. SO2 – сернистый газ Характеристика и свойства Бесцветный газ с резким запахом Ядовит Тяжелее воздуха Хорошо
- 3. Получение. 1. В промышленности: обжиг сульфидов 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 2. В лаборатории:
- 4. Химические свойства SO2 + H2O ↔ H2SO3 Na2O + SO2 → Na2SO3 2NaOH + SO2 →
- 5. SO3 – серный ангидрид Характеристика и свойства Бесцветная жидкость При температуре Гигроскопичен
- 6. Получение. В промышленности 2SO2 + O2 → 2SO3 В лаборатории Fe2(SO4)3 → Fe2O3 + 3SO3 to,
- 7. Химические свойства SO3 + H2O → H2SO4 SO3 + NaOH → Na2SO4 + H2O
- 8. Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа
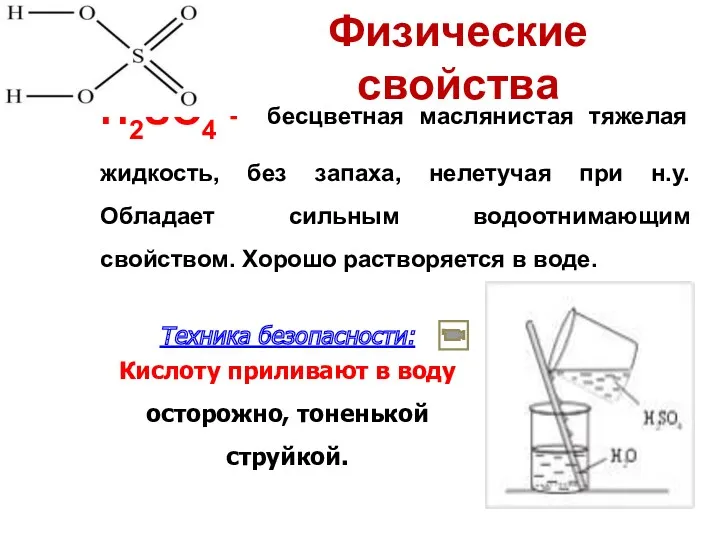
- 9. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 10. Химические свойства
- 11. Химические свойства разбавленной H2SO4 1. Взаимодействие с металлами (Стоящими до Н в ЭРНМ) Zn + H2SO4
- 12. Химические свойства разбавленной H2SO4 3. Взаимодействие с основаниями: а) щелочами H2SO4 + 2NaOH = Na2SO4 +
- 13. Химические свойства концентрированной H2SO4 Концентрированная H2SO4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами
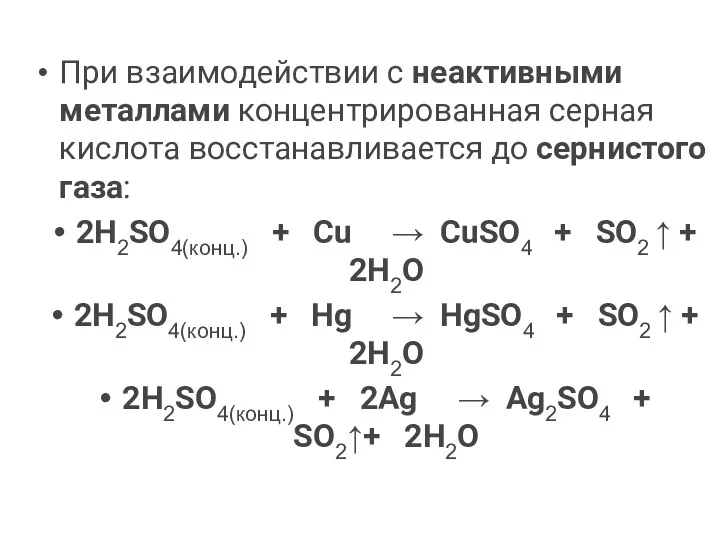
- 14. При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа: 2H2SO4(конц.) + Cu →
- 15. При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы: 3Mg + 4H2SO4
- 16. Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
- 17. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами. Например, концентрированная серная кислота окисляет
- 18. Соли серной кислоты
- 19. СПАСИБО ЗА ВНИМАНИЕ! Вычисление массовой доли выхода продукта реакции
- 20. Домашнее задание Прочитать параграф 15 учебника, при необходимости добавить конспект Выполнить задания в презентации Выполнить задание
- 21. Задание. Определите степени окисления серы в соединениях : SO2, H2S, SO3, CaS, Na2SO4, NaHS, KHSO4, MgSO4,
- 22. Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А)
- 23. 1.Распределение электронов по энергетическим уровням в атоме серы: А. 2, 6. В. 2, 8, 6. Б.
- 25. Скачать презентацию



















 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов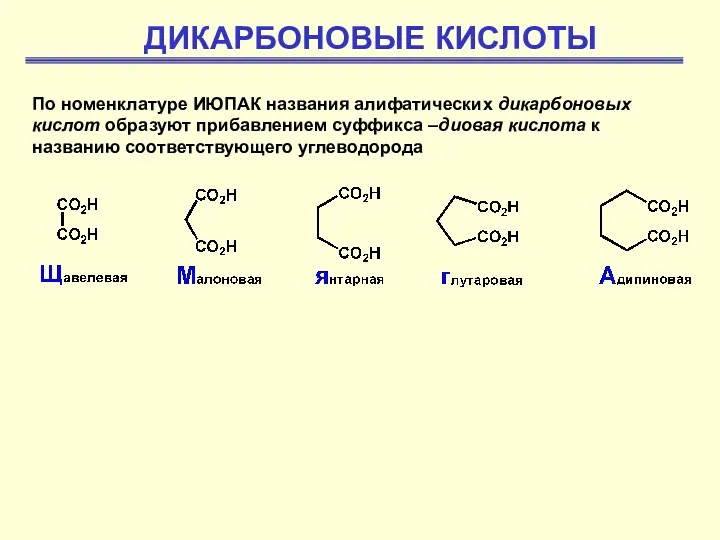 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка