Содержание
- 2. Историческая справка Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиус галогены (греч. hals – соль, gen –
- 3. Распространенность в природе галит NaCl сильвин KCl сильвинит KCl•NaCl флюорит CaF2
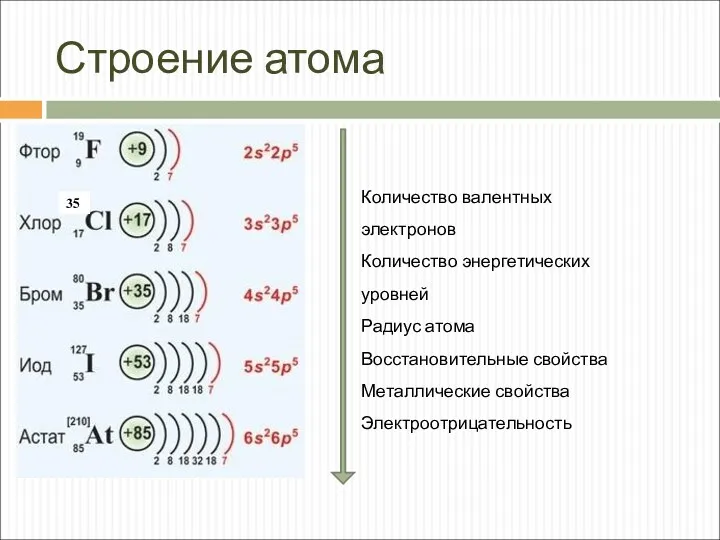
- 4. Строение атома 35 Количество валентных электронов Количество энергетических уровней Радиус атома Восстановительные свойства Металлические свойства Электроотрицательность
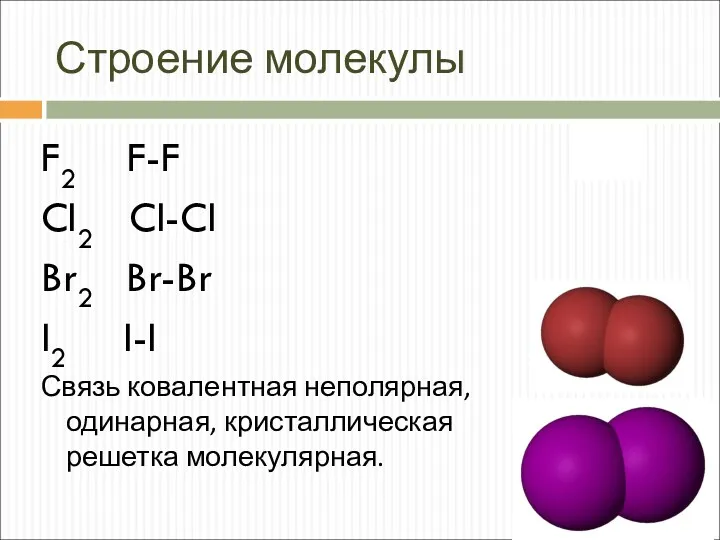
- 5. Строение молекулы F2 F-F Cl2 Cl-Cl Br2 Br-Br I2 I-I Связь ковалентная неполярная, одинарная, кристаллическая решетка
- 6. Физические свойства , способно к возгонке
- 7. Химические свойства 1) Взаимодействие с металлами: Cu + Cl2 = Fe + Cl2 = 2) Взаимодействие
- 8. Химические свойства 3) Взаимодействие с водой: 2F2 + 2H2O = 4HF + O2 H2O + Cl2
- 9. Химические свойства 5) Взаимодействие со щелочами на холоду: 2NaOH + Cl2 = NaCl + NaClO +
- 10. Получение F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: 2NaCl 2Na +
- 11. 1.В периодической системе галогены находятся в: А) главной подгруппе VIII группы; Б) побочной подгруппе VII группы;
- 12. 2.Для галогенов характерна степень окисления: А) -2; Б) -1 и -2; В) -2 и -3; Г)
- 13. 3.Галогены могут проявлять положительную степень окисления в соединениях с: А) водородом; Б) кислородом; В) с металлами;
- 14. 4.Как меняется химическая активность галогенов в ряду: F, Cl, Br, I? А) увеличивается; Б) меняется беспорядочно;
- 15. 5.При обычных условиях бром - это: А) газ; Б) жидкость; В) кристаллическое в-во; Г) жидкость или
- 16. 6.Галогены в твердом состоянии имеют: А) атомную кристаллическую решетку; Б) молекулярную кристаллическую решетку; В) А и
- 18. Скачать презентацию













 Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Каменный уголь
Каменный уголь Выдающиеся открытия в области химии
Выдающиеся открытия в области химии Признаки химических реакций. Урок химии в 8 классе
Признаки химических реакций. Урок химии в 8 классе Введение в нефтепереработку. Переработка нефти и газа
Введение в нефтепереработку. Переработка нефти и газа ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Минерал родонит. Месторождения
Минерал родонит. Месторождения Подгруппа углерода
Подгруппа углерода Электролитическая диссоциация
Электролитическая диссоциация Степень окисления
Степень окисления Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Нитраттарды қолдану
Нитраттарды қолдану Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Электролитическая диссоциация
Электролитическая диссоциация Химия в искусстве
Химия в искусстве Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Химическая связь
Химическая связь Катализаторы. Ферменты
Катализаторы. Ферменты Амины
Амины Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3)
Основные законы и теории. Законы стехиометрии. Теория ионных равновесий. (Лекция 3) Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов