Содержание
- 2. Предельные одноатомные спирты. Спирты – это органические соединения, в молекулах которых содержится одна или несколько гидроксильных
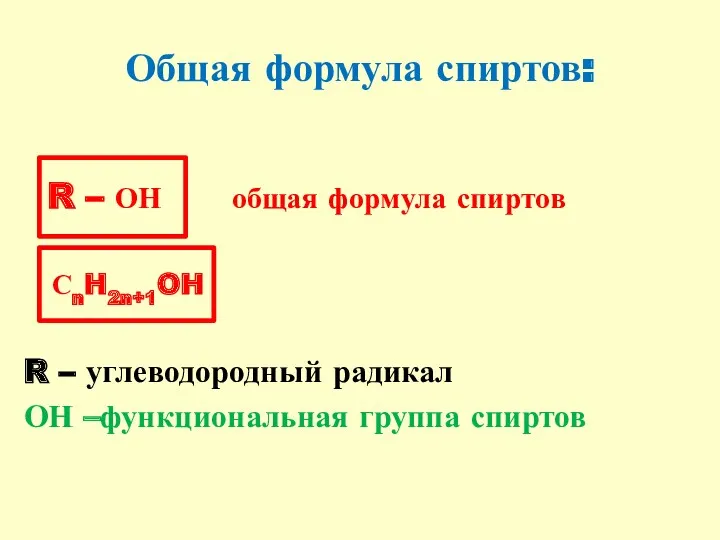
- 3. Общая формула спиртов: R – ОН общая формула спиртов СnH2n+1OH R – углеводородный радикал ОН –функциональная
- 4. Гомологический ряд спиртов. СН3 – ОН -метиловый спирт, метанол С2Н5 –ОН –этиловый спирт, этанол С3Н7 –ОН
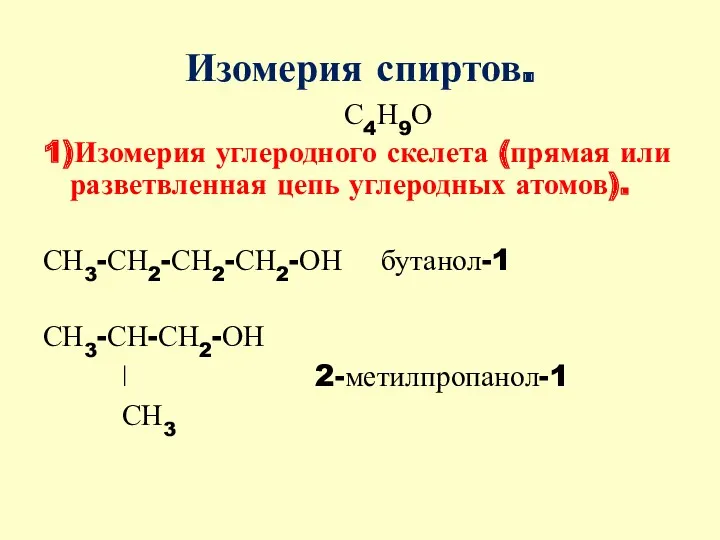
- 5. Изомерия спиртов. С4Н9О 1)Изомерия углеродного скелета (прямая или разветвленная цепь углеродных атомов). СН3-СН2-СН2-СН2-ОН бутанол-1 СН3-СН-СН2-ОН ǀ
- 6. 2)Изомерия по положению ОН- группы. СН3-СН2-СН2-СН2-ОН бутанол-1 первичный СН3-СН-СН2-СН3 бутанол-2 ǀ вторичный ОН 3) Спирты изомерны
- 7. Физические свойства спиртов. Низшие спирты – жидкости. Высшие (с С12 Н25ОН) – твердые вещества. С увеличением
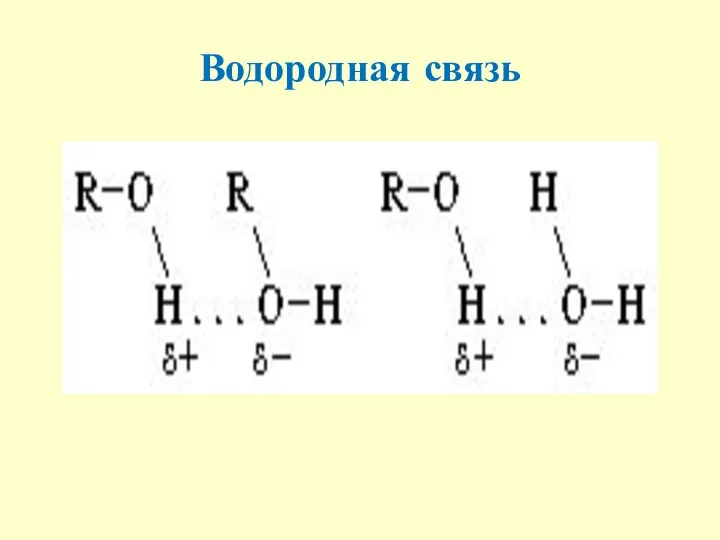
- 8. Водородная связь Образуется между водородом и сильно Э.О. элементами (О,F,N). Водородная связь образуется по донорно-акцепторному механизму,
- 9. Водородная связь
- 10. Химические свойства спиртов. Горение спиртов. С2Н5ОН + 3О2 →2СО2 + 3Н2О 2. Взаимодействие с Na –
- 11. 3. Дегидратация (отщепление воды). А) Внутримолекулярная С2Н5ОН → С2Н4 + Н2О этилен Б) Межмолекулярная – образуются
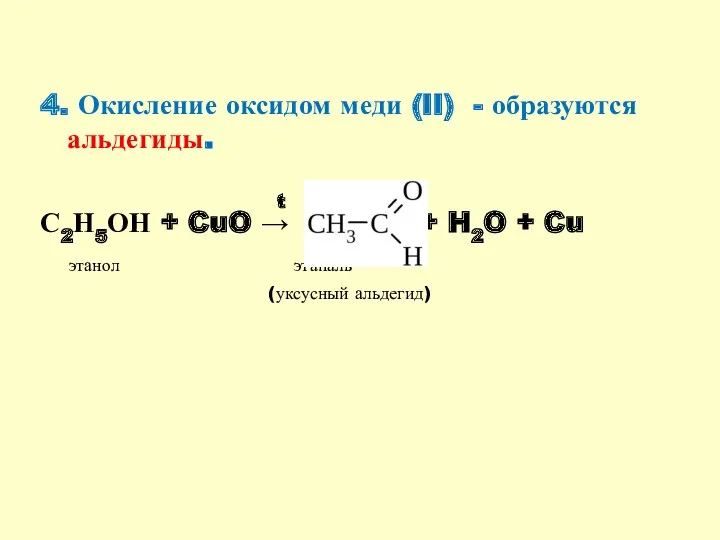
- 12. 4. Окисление оксидом меди (II) - образуются альдегиды. С2Н5ОН + CuO → + H2O + Cu
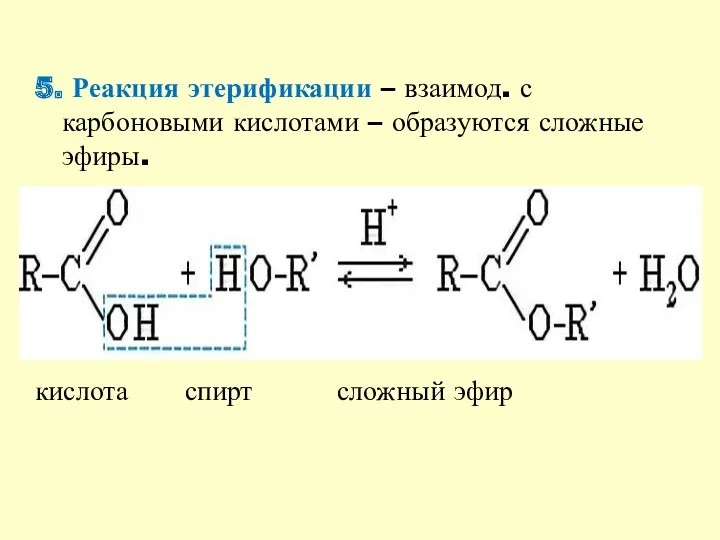
- 13. 5. Реакция этерификации – взаимод. с карбоновыми кислотами – образуются сложные эфиры. кислота спирт сложный эфир
- 14. CН3 –СООН + НОСН3 СН3 – СООСН3 + H2O Н2SO4 конц, t уксусная кислота метанол метилацетат
- 15. Получение спиртов. Общие способы получения спиртов. Гидролиз галогеналкилов. С2Н5I + HOH → С2Н5OH + HI C3H7Cl
- 16. II. Частные способы получения спиртов. Каталитическое гидрирование СО. СО + 2Н2 → СН3ОН метанол 2. Спиртовое
- 17. Многоатомные спирты - это органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным
- 18. Многоатомные спирты. СН2 – ОН этиленгликоль СН2 – ОН (представитель двухатомных спиртов – гликолей) СН2 –
- 19. Физические свойства. Этиленгликоль и глицерин – б/ц сиропообразные жидкости сладковатого вкуса. Хорошо растворяются в воде и
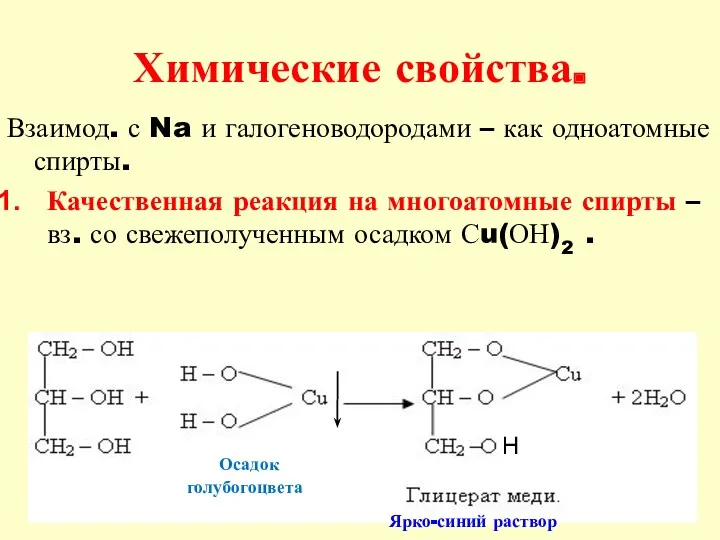
- 20. Химические свойства. Взаимод. с Na и галогеноводородами – как одноатомные спирты. Качественная реакция на многоатомные спирты
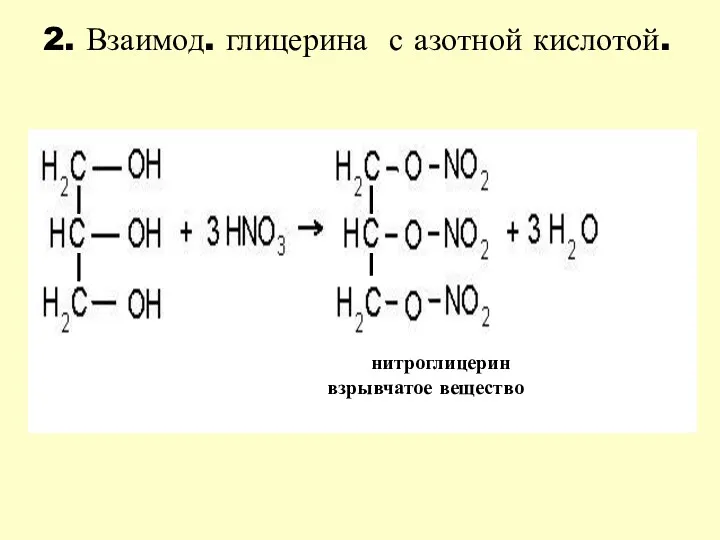
- 21. 2. Взаимод. глицерина с азотной кислотой. нитроглицерин взрывчатое вещество
- 22. Получение многоатомных спиртов. Окисление этилена раствором КMnO4 – получение этиленгликоля. 3СН2=СН2 + 2КMnO4 + 4 H2O
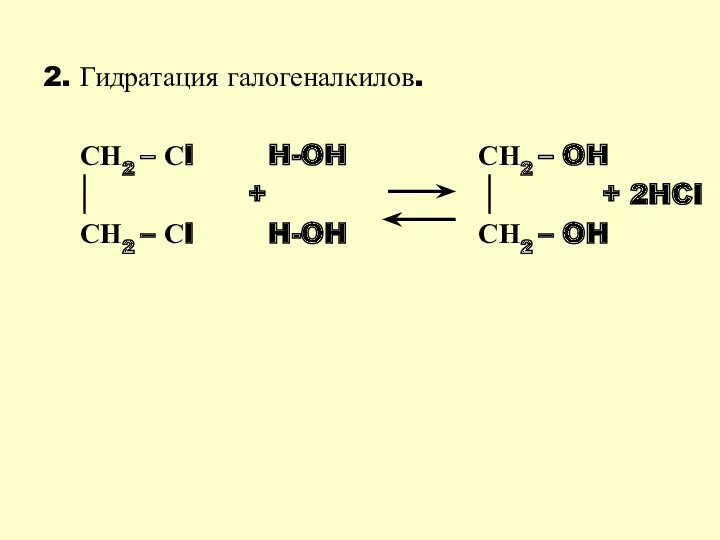
- 23. 2. Гидратация галогеналкилов. СН2 – Сl H-OH СН2 – OH + + 2HCl СН2 – Сl
- 25. Скачать презентацию







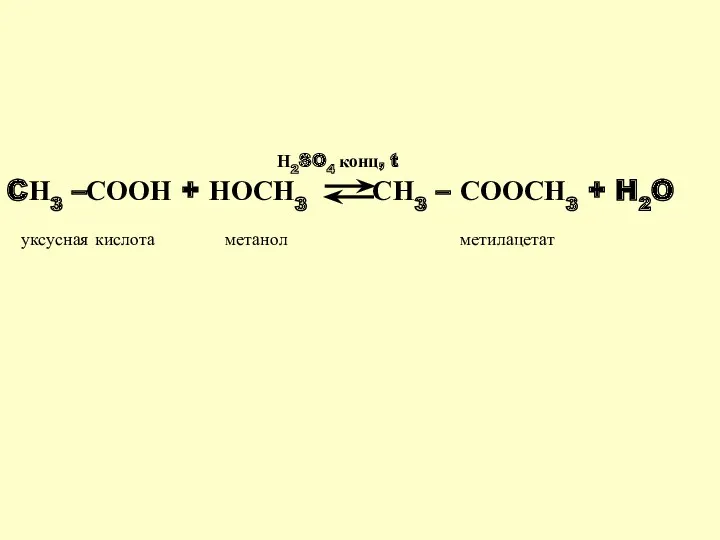






 Термопластичные полимеры
Термопластичные полимеры Оксиды. Названия оксидов
Оксиды. Названия оксидов Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Химическая промышленность
Химическая промышленность Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку Химический элемент фтор
Химический элемент фтор Аммиак
Аммиак ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 Введение в органическую химию
Введение в органическую химию Цинковое покрытие
Цинковое покрытие Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Влияние фтора на организм человека
Влияние фтора на организм человека Получение и применение алканов
Получение и применение алканов Медь, графит, алмаз
Медь, графит, алмаз Центрифугирование в цитологии
Центрифугирование в цитологии Застосування засобів захисту органів дихання від небезпечних хімічних речовин
Застосування засобів захисту органів дихання від небезпечних хімічних речовин Гидролиз солей
Гидролиз солей Строение и свойства циклоалканов
Строение и свойства циклоалканов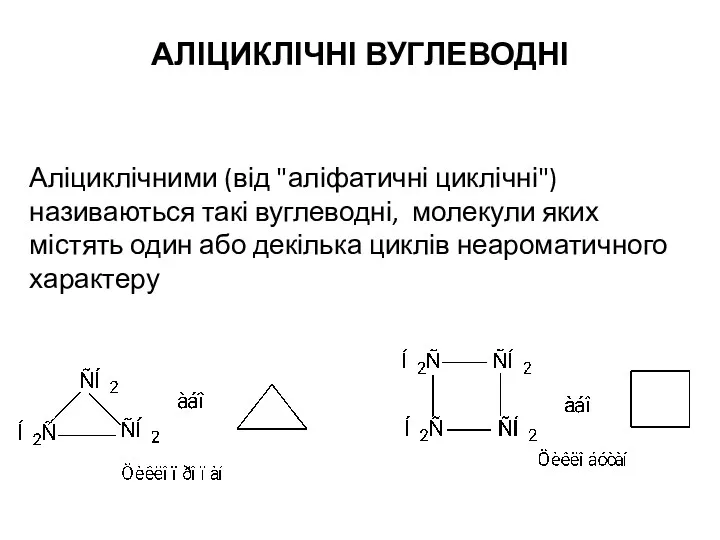 Аліциклічні вуглеводні
Аліциклічні вуглеводні Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів
Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів Процессы проявления и фиксирования
Процессы проявления и фиксирования Валентность элементов. Определение валентности по формулам
Валентность элементов. Определение валентности по формулам Графит
Графит Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті