Содержание
- 2. ПЛАН. ОпределениеОпределение. Определение. Общая формула класса углеводородовОпределение. Общая формула класса углеводородов. Гомологический рядГомологический ряд. Виды изомерииВиды
- 3. АЛКАНЫ. (ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. ПАРАФИНЫ. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ.) Алканы - углеводороды в молекулах которых все атомы углерода связаны
- 4. ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНА СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16
- 5. ИЗОМЕРИЯ АЛКАНОВ Структурная изомерия: CH3 - CH2 - CH2 - CH2 - CH3 или CH3 –
- 6. НОМЕНКЛАТУРА АЛКАНОВ Алгоритм. Выбор главной цепи: CH3 – CH - CH2 - CH3 │ CH3
- 7. НОМЕНКЛАТУРА АЛКАНОВ 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH - CH2
- 8. НОМЕНКЛАТУРА АЛКАНОВ 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3
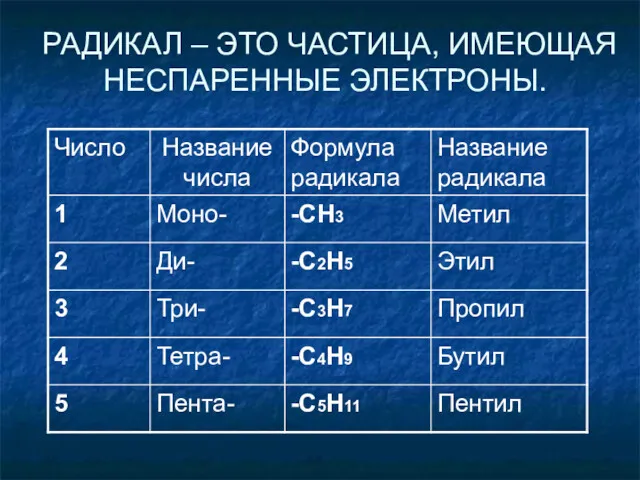
- 9. РАДИКАЛ – ЭТО ЧАСТИЦА, ИМЕЮЩАЯ НЕСПАРЕННЫЕ ЭЛЕКТРОНЫ.
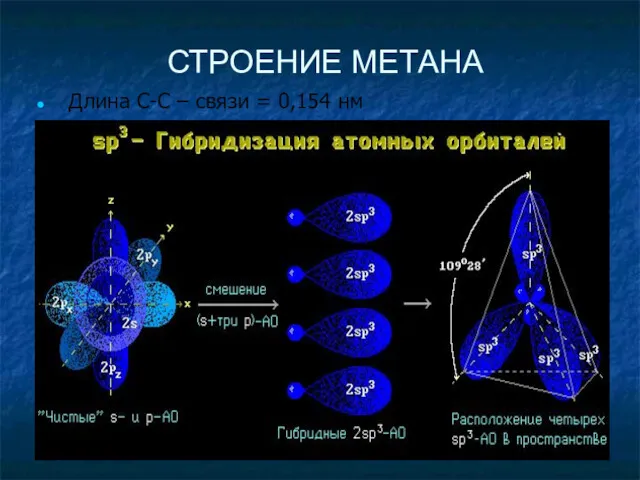
- 10. СТРОЕНИЕ МЕТАНА Длина С-С – связи = 0,154 нм
- 11. СТРОЕНИЕ МЕТАНА
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
- 13. Получение алканов 1 - выделение углеводородов из природного сырья 2 - гидрирование циклоалканов и непредельных углеводородов
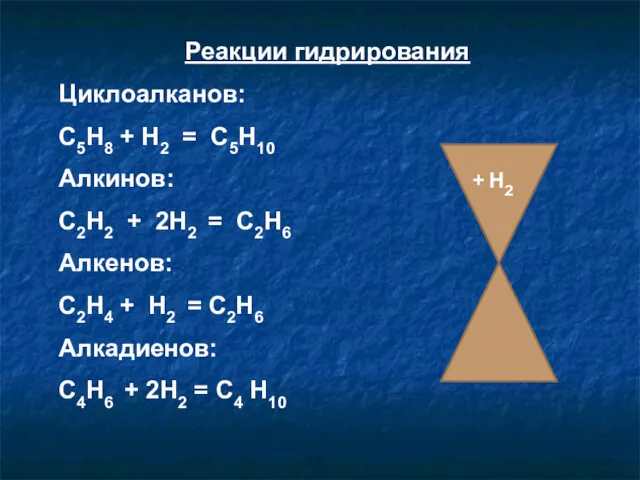
- 14. Реакции гидрирования Циклоалканов: С5Н8 + Н2 = С5Н10 Алкинов: С2Н2 + 2Н2 = С2Н6 Алкенов: С2Н4
- 15. Получение метана при сплавлении ацетата натрия со щелочью: t °C CH3COONa + NaOH ⎯⎯→ CH4 ⇑
- 16. Синтез Вюрца Проводят с целью получения алканов с более длинной углеродной цепью. Например: получение этана из
- 17. Метан в лаборатории можно получить гидролизом карбида алюминия Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
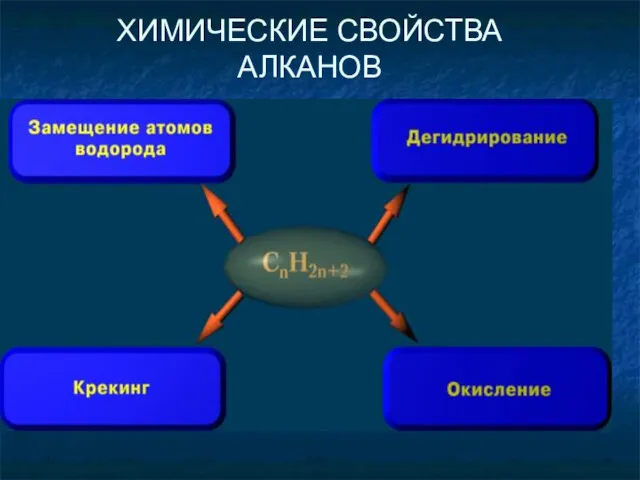
- 18. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
- 19. СН4 + Сl2 CH3Cl + HCl + Q t Реакции протекают по радикальному механизму. С Н
- 20. 2. Реакции изомеризации: СН3 СН2 СН2 СН2 СН3 t, катализатор СН3 СН СН2 СН3 СН3 3.Реакции
- 21. 6. РЕАКЦИЯ ГОРЕНИЯ: CH4 + 2O2 → CO2 + 2H2O + Q
- 22. Применение Получение ацетилена Горючее для дизельных и турбореактивных двигателей Получение растворителей В металлургии А также сырьё
- 24. Скачать презентацию

















 Химия в жизни общества
Химия в жизни общества Organic molecules
Organic molecules Первичная переработка нефти
Первичная переработка нефти Состав газированной воды
Состав газированной воды Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Галогены (солеобразующие)
Галогены (солеобразующие) Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углекислый газ
Углекислый газ Неон. Получение
Неон. Получение Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
 Химическая связь
Химическая связь Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Типы химических реакций в органической химии
Типы химических реакций в органической химии СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Хімічні сполуки у побуті
Хімічні сполуки у побуті Основные классы неорганических веществ
Основные классы неорганических веществ Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Химический элемент и вещество
Химический элемент и вещество Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива