Содержание
- 2. Определение Углеводы –это органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород
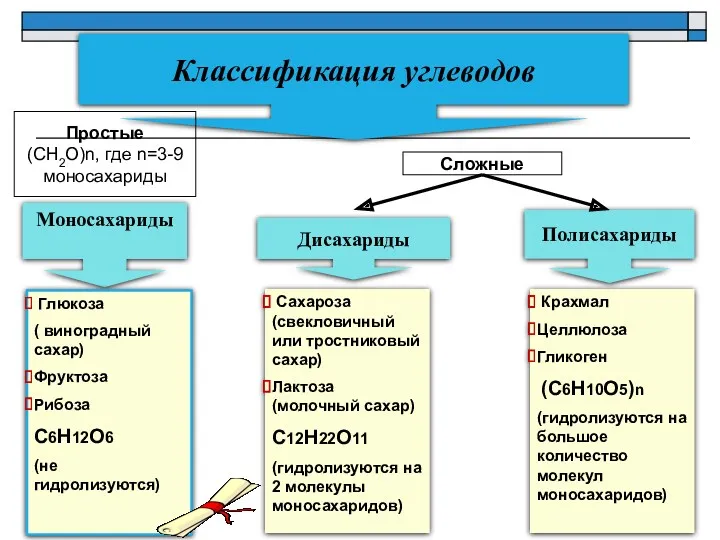
- 3. Крахмал Целлюлоза Гликоген (С6Н10О5)n (гидролизуются на большое количество молекул моносахаридов) Классификация углеводов Моносахариды Дисахариды Полисахариды Глюкоза
- 4. Изомерия моносахаридов Наиболее часто встречаются два моносахарида: глюкоза и фруктоза. Они являются изомерами и имеют молекулярну
- 5. Глюкоза - виноградный сахар встречается почти во всех органах растения в плодах, корнях, листьях, цветах; особенно
- 6. Физические свойства глюкозы бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» –
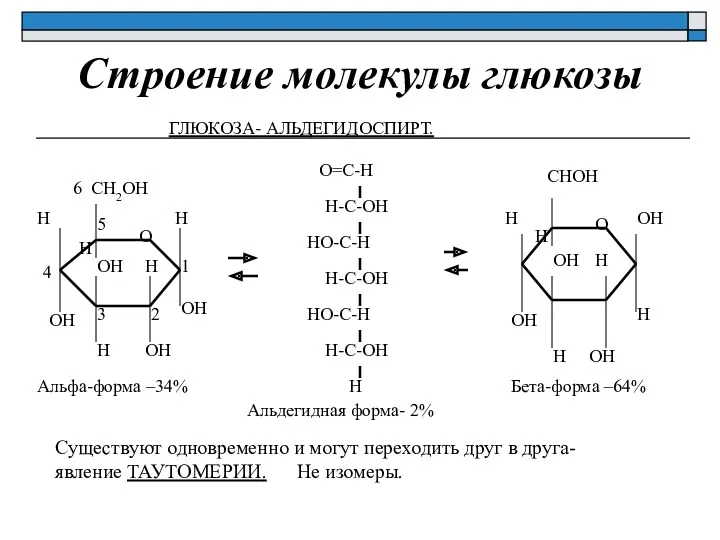
- 7. Строение молекулы глюкозы ГЛЮКОЗА- АЛЬДЕГИДОСПИРТ. О Н ОН Н ОН ОН Н Н ОН Н СН2ОН
- 8. Строение молекулы фруктозы. ФРУКТОЗА или ФРУКТОВЫЙ САХАР содержится в плодах и мёде. Слаще глюкозы. ФРУКТОЗА- КЕТОНОСПИРТ,
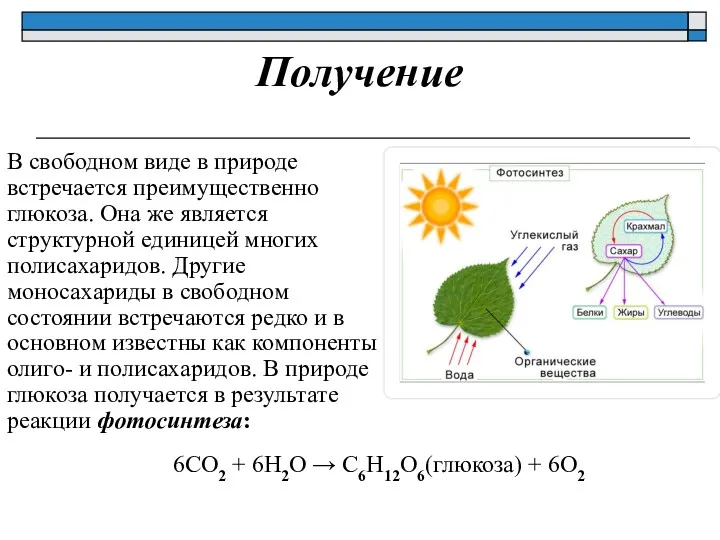
- 9. Получение В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов.
- 10. Впервые глюкоза получена в 1811 году русским химиком Г.Э. Кирхгофом при гидролизе крахмала. Позже синтез моносахаридов
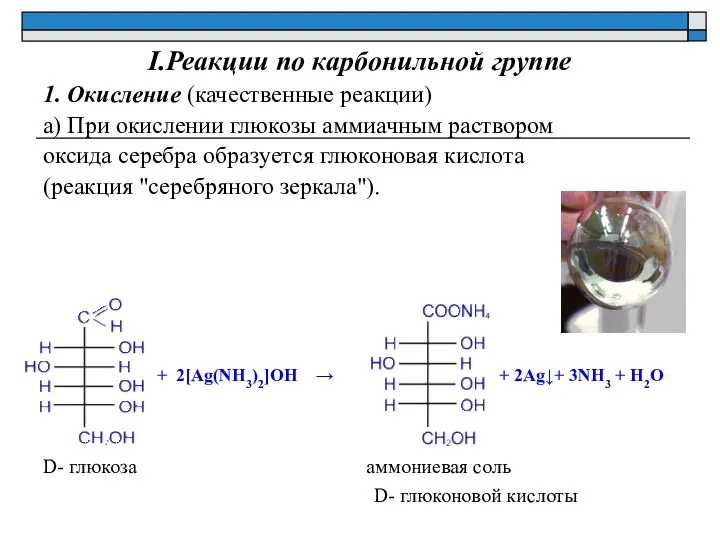
- 11. I.Реакции по карбонильной группе 1. Окисление (качественные реакции) а) При окислении глюкозы аммиачным раствором оксида серебра
- 12. б) Реакция глюкозы с гидроксидом меди при нагревании так же приводит к образованию глюконовой кислоты. O
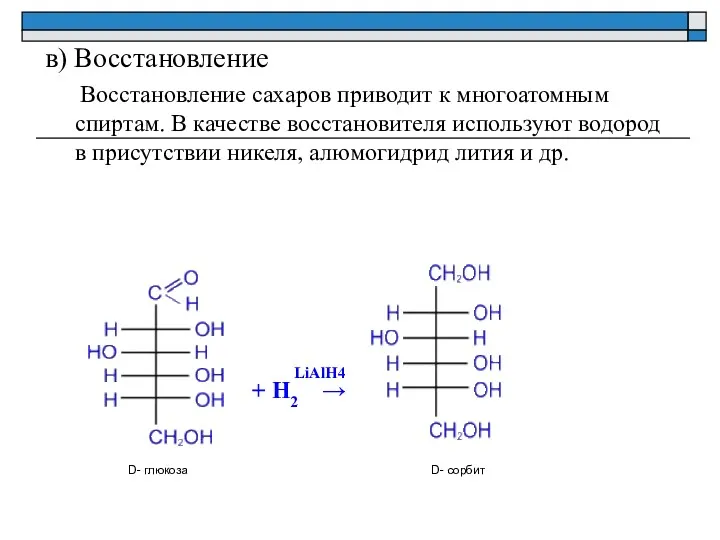
- 13. в) Восстановление Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля,
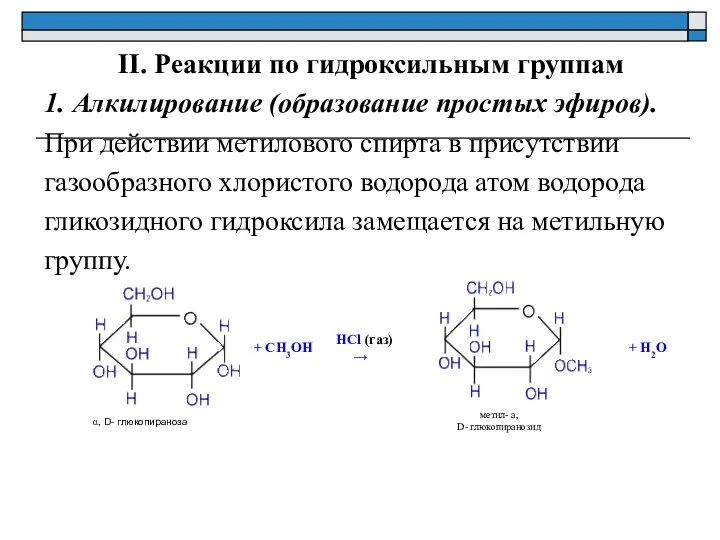
- 14. II. Реакции по гидроксильным группам 1. Алкилирование (образование простых эфиров). При действии метилового спирта в присутствии
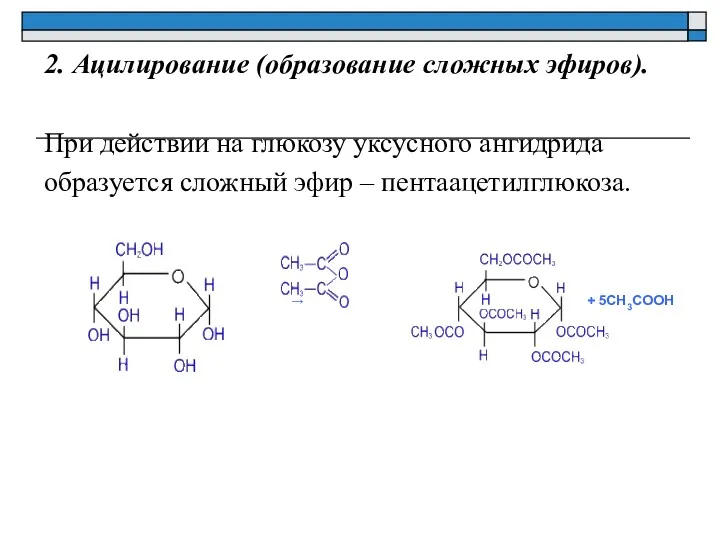
- 15. 2. Ацилирование (образование сложных эфиров). При действии на глюкозу уксусного ангидрида образуется сложный эфир – пентаацетилглюкоза.
- 16. 3. Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная
- 17. III. Специфические реакции Глюкоза характеризуется и некоторыми специфическими свойствами – процессами брожения. Брожением называется расщепление молекул
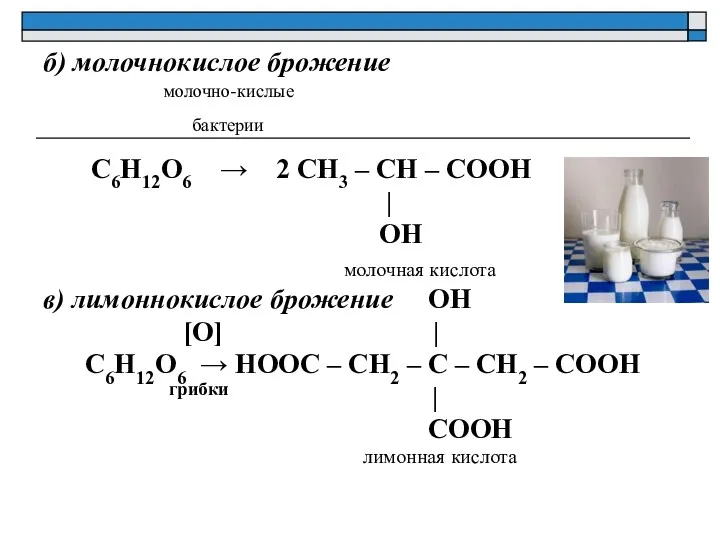
- 18. б) молочнокислое брожение молочно-кислые бактерии C6H12O6 → 2 CH3 – CH – COOH | OH молочная
- 19. г) маслянокислое брожение масляно-кислые бактерии C6H12O6 → CH3 – CH2 – CH2 – COOH + 2H2O
- 20. IV.Горение и разложение глюкозы. Как все органические вещества, глюкоза может гореть и разлагаться при нагревании: C6H12O6
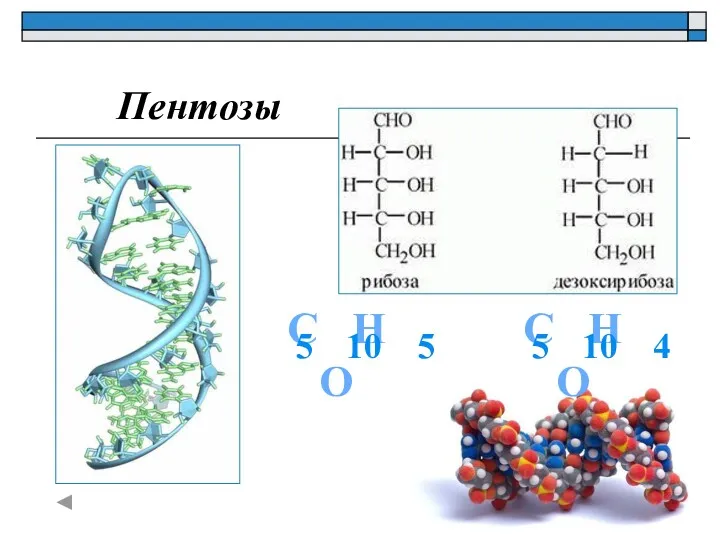
- 21. Пентозы
- 22. Дисахариды Дисахариды - это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом
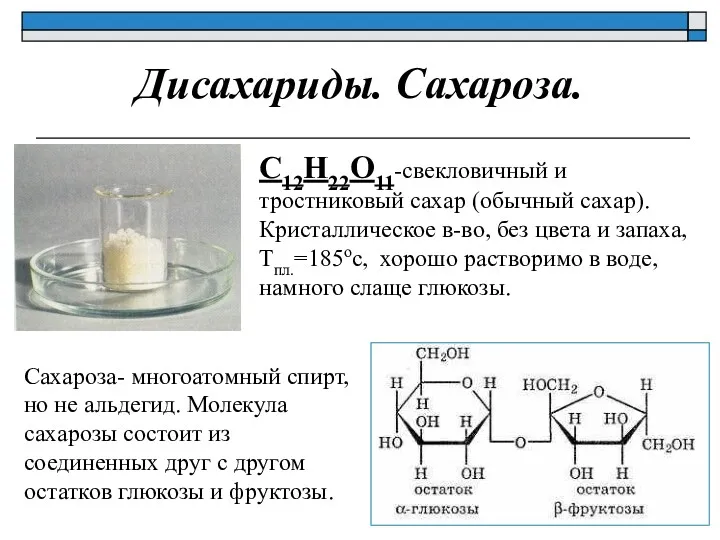
- 23. Дисахариды. Сахароза. С12Н22О11-свекловичный и тростниковый сахар (обычный сахар). Кристаллическое в-во, без цвета и запаха, Тпл.=185ос, хорошо
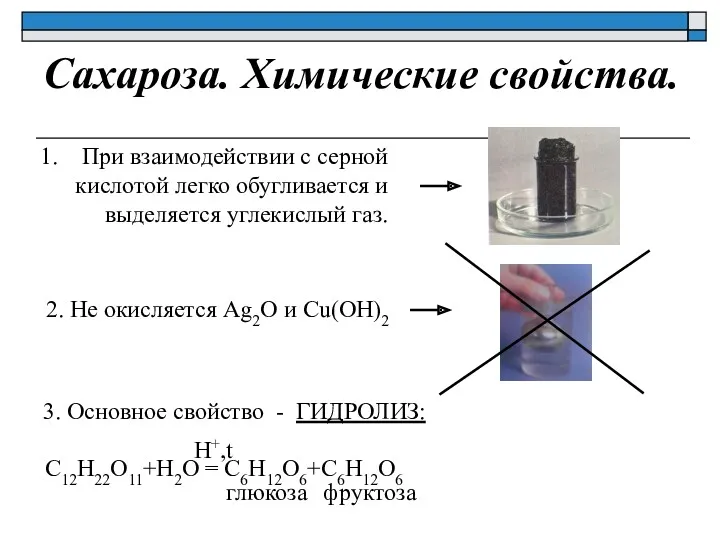
- 24. Сахароза. Химические свойства. При взаимодействии с серной кислотой легко обугливается и выделяется углекислый газ. 3. Основное
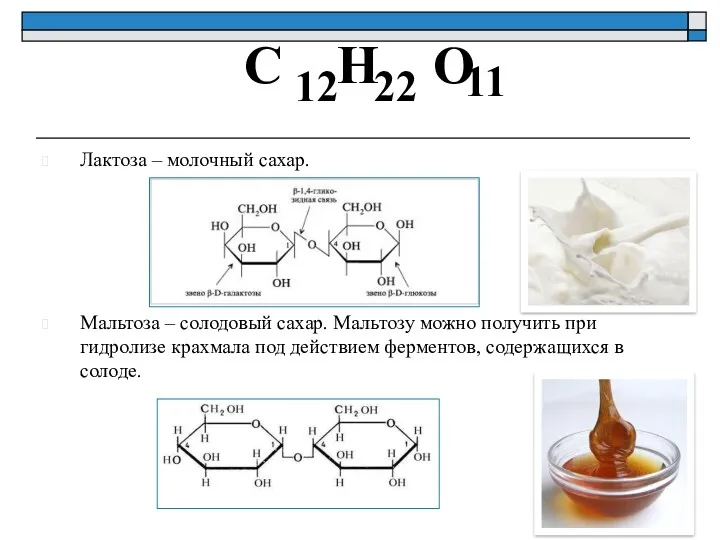
- 25. Лактоза – молочный сахар. Мальтоза – солодовый сахар. Мальтозу можно получить при гидролизе крахмала под действием
- 26. Химические свойства дисахаридов Для дисахаридов характерна реакция гидролиза, в результате которой образуются две молекулы моносахаридов: C12H22O11
- 27. Полисахариды: Полисахариды состоят из моносахаридов. Большие размеры делают их молекулы практически нерастворимыми в воде; они не
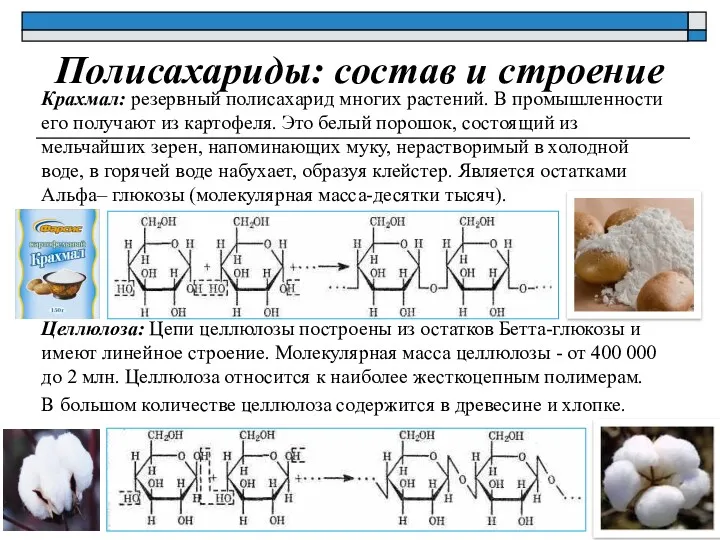
- 28. Полисахариды: состав и строение Крахмал: резервный полисахарид многих растений. В промышленности его получают из картофеля. Это
- 29. Химические свойства крахмала Крахмал подвергается гидролизу. Конечным продуктом гидролиза является глюкоза Взаимодействие крахмала с йодом –
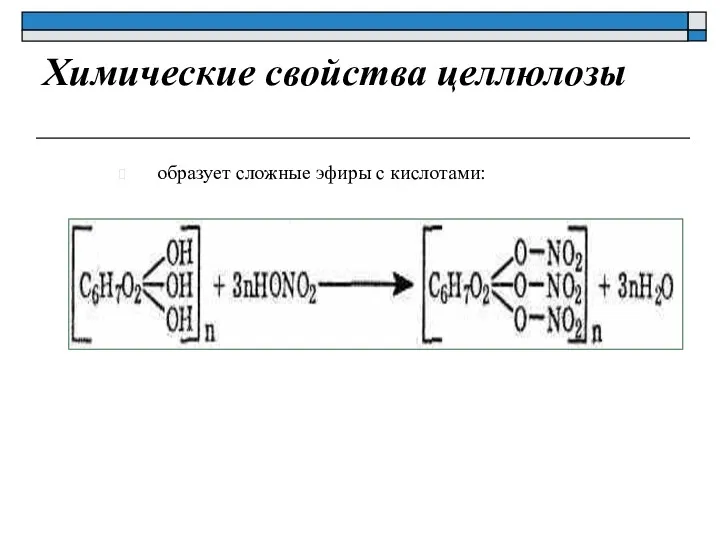
- 30. Химические свойства целлюлозы образует сложные эфиры с кислотами:
- 32. Скачать презентацию















 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Строение атома. 8 класс
Строение атома. 8 класс Protein and amino acid metabolism
Protein and amino acid metabolism Химические свойства солей
Химические свойства солей Растворы ВМС и их свойства
Растворы ВМС и их свойства Композиционные материалы
Композиционные материалы Алкени і алкіни
Алкени і алкіни Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Пластмассы
Пластмассы 9 Амины
9 Амины №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу Липиды; классификация; строение; значение для жизнедеятельности организмов
Липиды; классификация; строение; значение для жизнедеятельности организмов Возникновение и развитие научной химии
Возникновение и развитие научной химии Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Электролитическая диссоциация
Электролитическая диссоциация Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Амины
Амины Дисперсные системы. Свойства коллоидных растворов
Дисперсные системы. Свойства коллоидных растворов Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Углеводы. Моносахариды
Углеводы. Моносахариды Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Значення хімічних процесів у природі
Значення хімічних процесів у природі Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Искусственные полимеры
Искусственные полимеры Месторождения турмалина
Месторождения турмалина Электронное строение атома
Электронное строение атома