Содержание
- 2. Электролитическая диссоциация
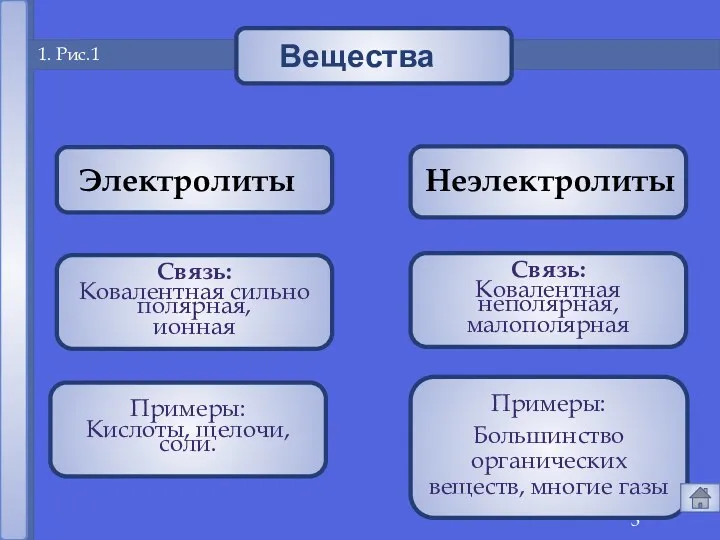
- 3. 1 1. Рис.1 Электролиты Неэлектролиты
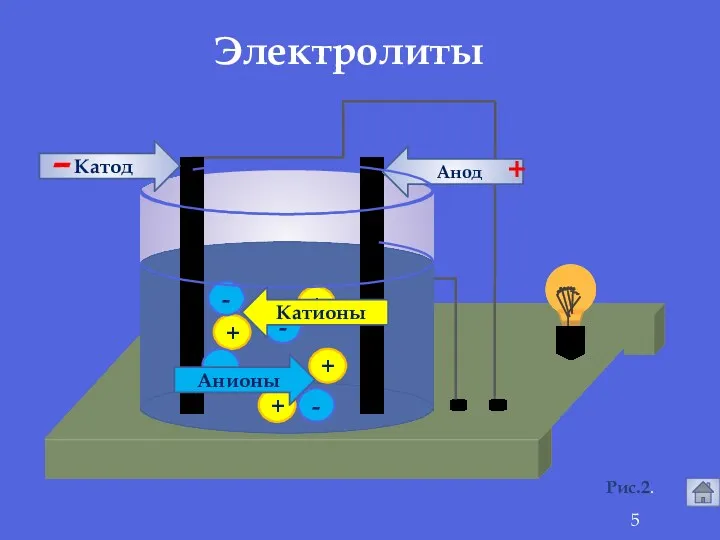
- 4. 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
- 5. + + + + - - - - Анионы Катионы Анод Катод - + Электролиты Рис.2.
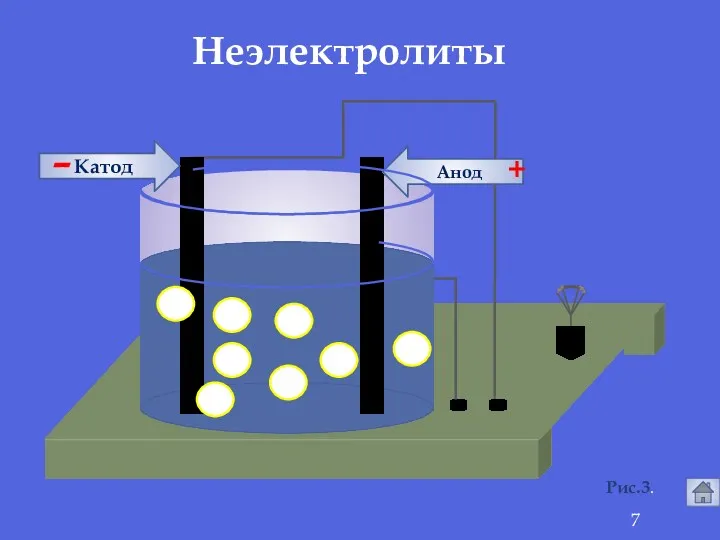
- 6. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты -
- 7. Анод Катод - + Рис.3. Неэлектролиты
- 8. «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул электролита
- 9. «Честь науке- ей дано уменье, выводить нас из заблужденья». 2.Электролитическая диссоциация Кратко об Аррениусе Сванте Августе
- 10. Основные положения теории электролитической диссоциации 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы –
- 11. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Выражается в % Степень электролитической
- 12. Электролиты Сильные α=1 Растворимые соли Сильные кислоты (HCL, HI) Щелочи (NaOH, KOH) Слабые α Слабые кислоты
- 13. Неэлектролиты α=0 Оксиды, не взаимодействующие с H2O Простые вещества Большинство органических веществ
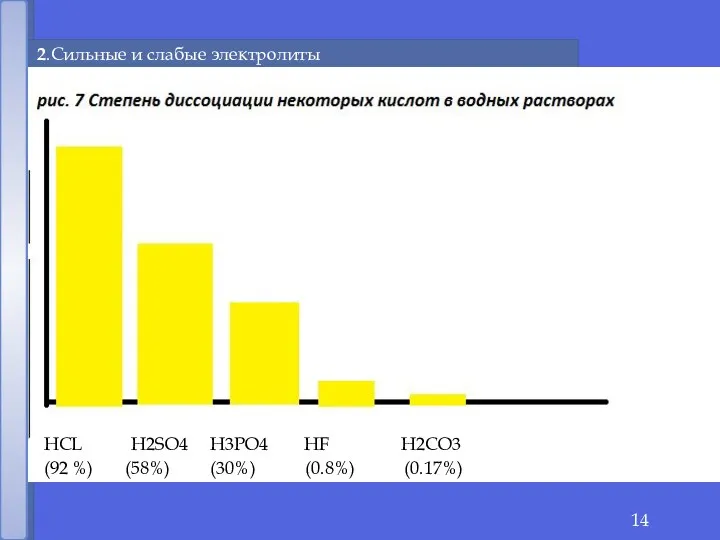
- 14. 2.Сильные и слабые электролиты % НСL H2SO4 H3PO4 HF H2CO3 (92 %) (58%) (30%) (0.8%) (0.17%)
- 15. это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода.
- 16. - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы.
- 17. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Соли
- 18. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 19. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека
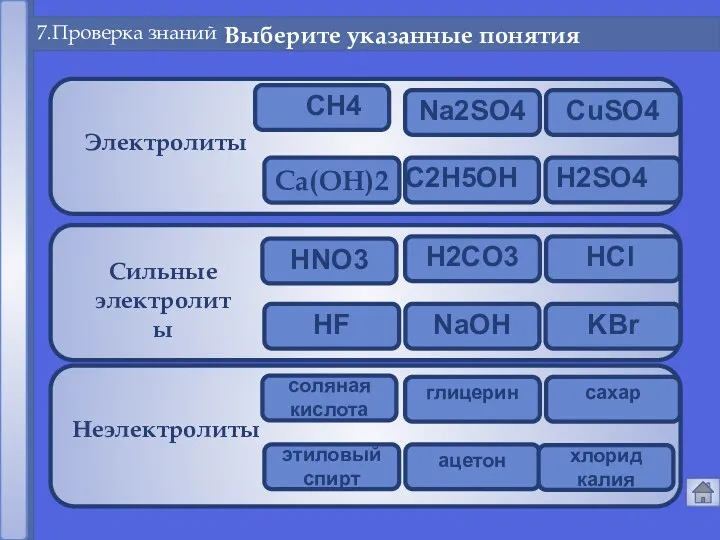
- 20. Сильные электролиты Ca(OH)2 Электролиты Неэлектролиты 7.Проверка знаний Выберите указанные понятия
- 22. Скачать презентацию














 Цветные металлы и сплавы
Цветные металлы и сплавы Массовая доля вещества в растворе
Массовая доля вещества в растворе Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Технология промышленных газов
Технология промышленных газов Химия вокруг нас
Химия вокруг нас Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Перегонка с водяным паром
Перегонка с водяным паром Липиды. Классификация липидов
Липиды. Классификация липидов Основания. Номенклатура оснований
Основания. Номенклатура оснований Химические свойства металлов
Химические свойства металлов Процесс в химическом реакторе
Процесс в химическом реакторе Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Спирты
Спирты Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Тяжелые металлы
Тяжелые металлы Горение жидкостей
Горение жидкостей Определение фосфатов, железа, хлоридов
Определение фосфатов, железа, хлоридов Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Металлическая связь
Металлическая связь Химический состав воздуха
Химический состав воздуха Сладкая жизнь. Проектно-исследовательская работа
Сладкая жизнь. Проектно-исследовательская работа Хімічні явища в побуті
Хімічні явища в побуті Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)