Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) презентация
Содержание
- 3. Основные характеристики атома
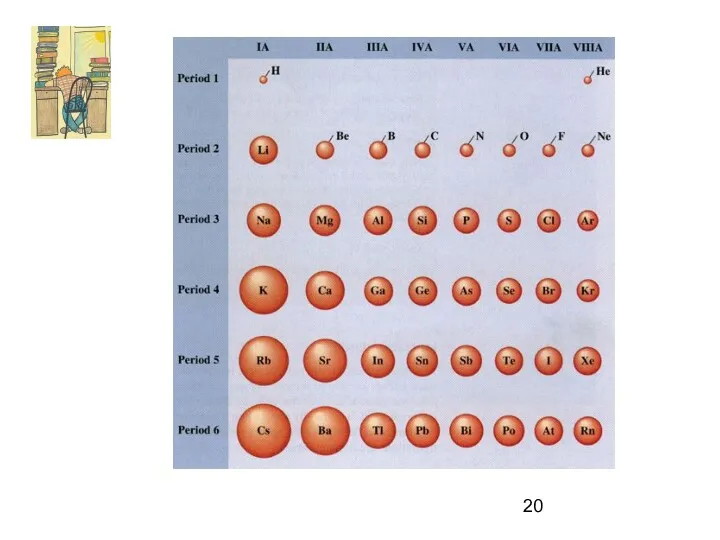
- 4. Атомный радиус (ra)
- 5. Энергия присоединения или отрыва электронов от атома зависит от радиуса атомов Энергия ионизации ( Еи )
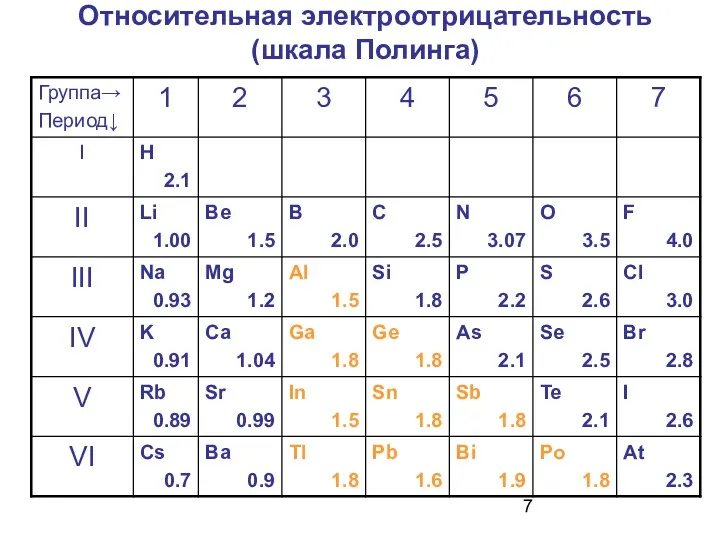
- 6. Относительная электроотрицательность (ОЭО) атомов характеризует способность атома притягивать к себе общие электроны в молекуле Полинг принял:
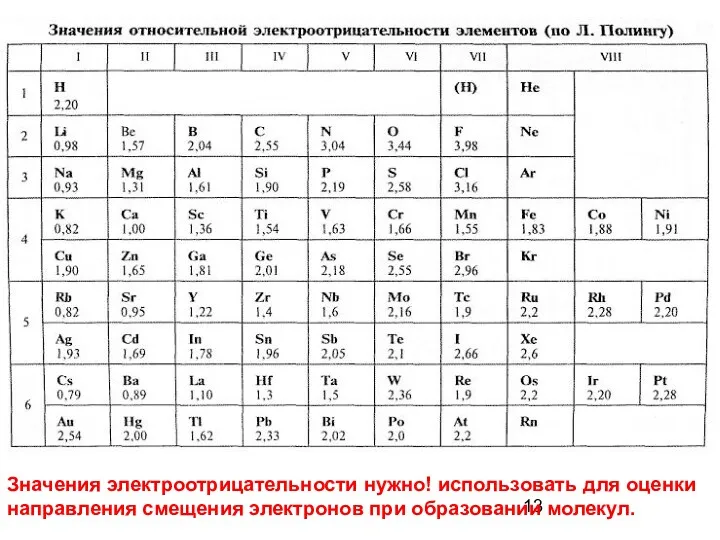
- 7. Относительная электроотрицательность (шкала Полинга)
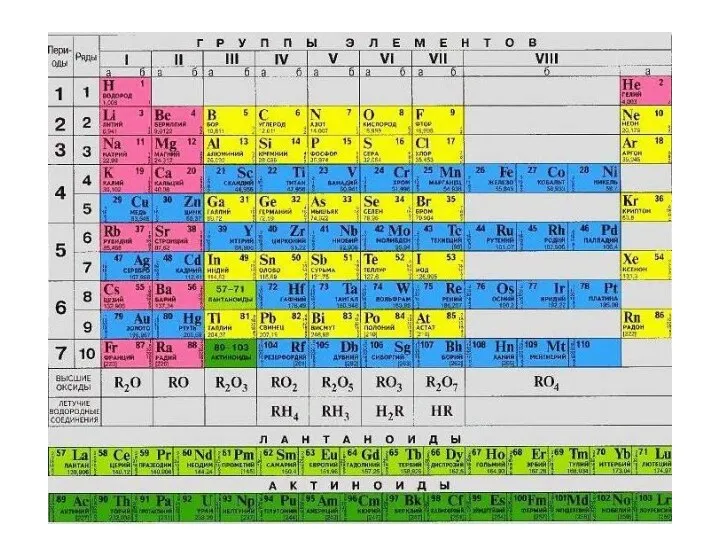
- 9. Изменение свойств элементов и их соединений в периодах и группах
- 10. Химические свойства элемента зависят от способности атома отдавать (металлические свойства) или присоединять (неметаллические свойства) электроны, что
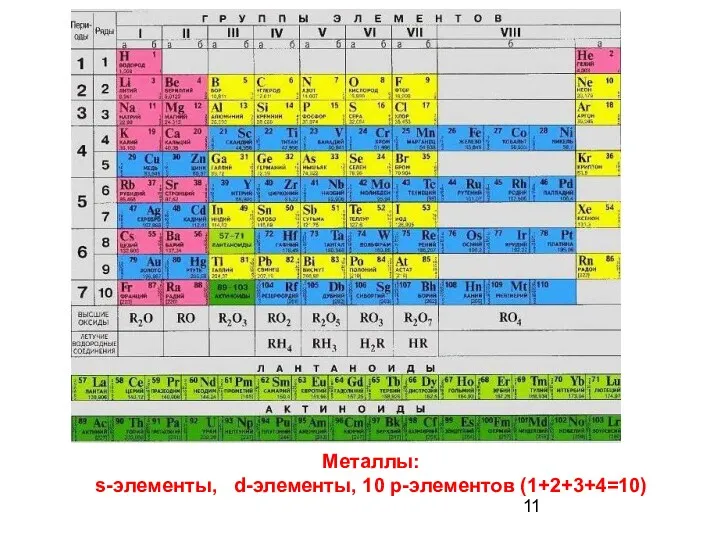
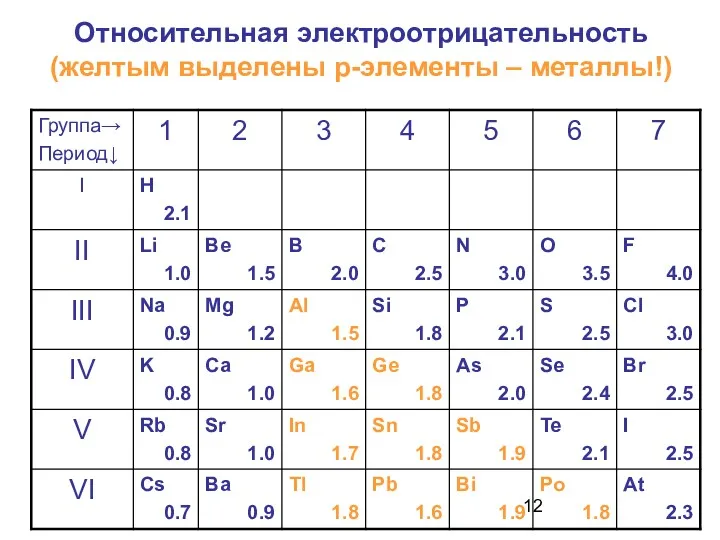
- 11. Металлы: s-элементы, d-элементы, 10 р-элементов (1+2+3+4=10)
- 12. Относительная электроотрицательность (желтым выделены р-элементы – металлы!)
- 13. Значения электроотрицательности нужно! использовать для оценки направления смещения электронов при образовании молекул.
- 14. А-группы: Металлические свойства в периоде ослабевают, в группах нарастают, но!!!! Б-группы: У d-элементов электроны попадают на
- 15. Атомы металлов всегда отдают электроны и степень окисления у них только положительная! Атомы неметаллов могут иметь
- 16. Атомы металлов – только восстановители! Атомы неметаллов, как правило, – окислители, но в реакциях с более
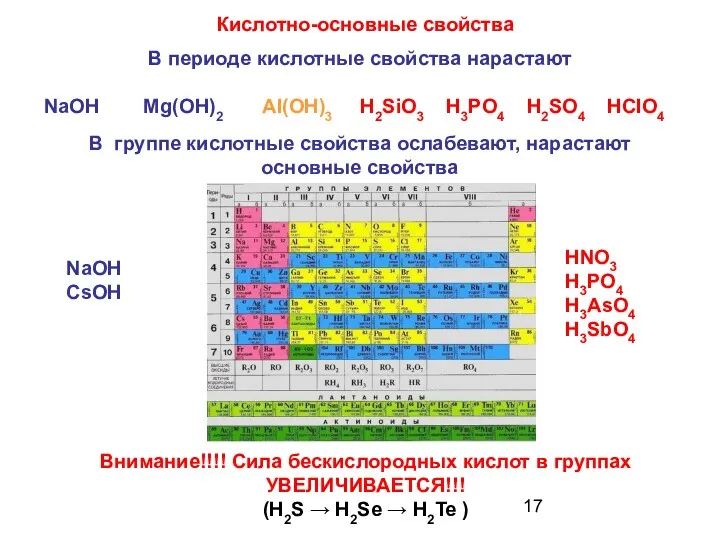
- 17. Кислотно-основные свойства В периоде кислотные свойства нарастают NaOH Mg(OH)2 AI(OH)3 H2SiO3 H3PO4 H2SO4 HCIO4 В группе
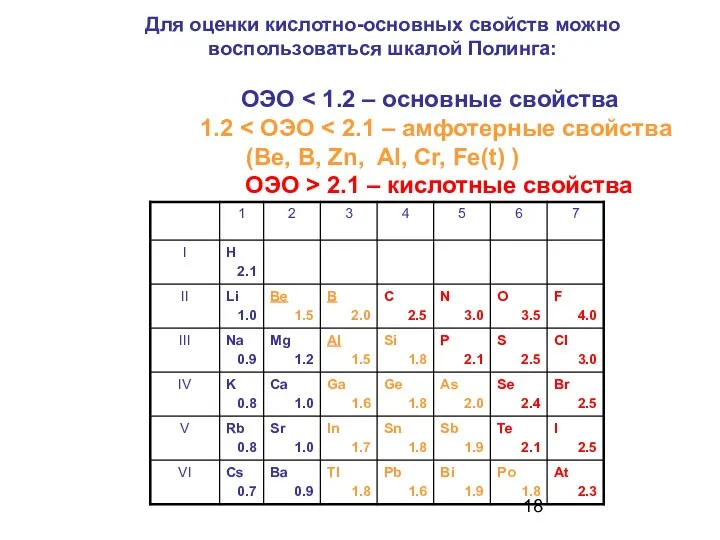
- 18. Для оценки кислотно-основных свойств можно воспользоваться шкалой Полинга: ОЭО 2.1 – кислотные свойства
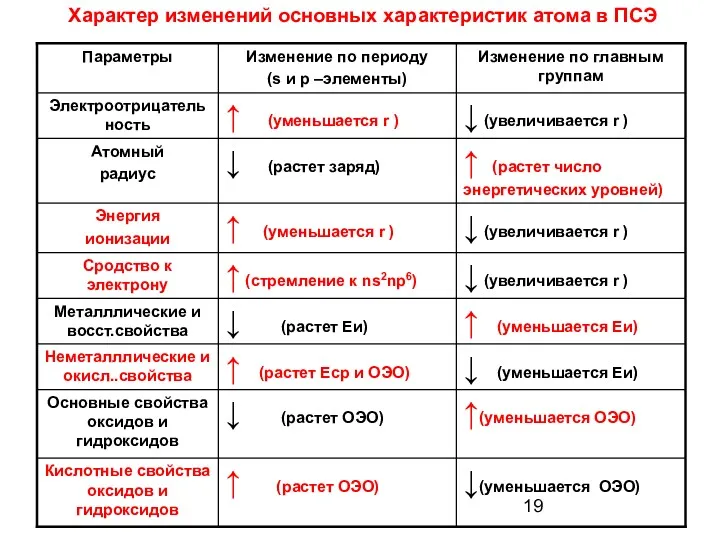
- 19. Характер изменений основных характеристик атома в ПСЭ
- 21. Тест №4 Основные характеристики атома (один вариант ответа)
- 22. 1. Химические элементы расположены в порядке возрастания их атомного радиуса в ряду: 1) Be,B,C,N 2) Rb,K,Na,Li
- 23. 2. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Na,Mg,Al,Si 2)
- 24. 3. Наибольший радиус имеют атомы: 1) азота 2) висмута 3) сурьмы 4) мышьяка
- 25. 4. В каком ряду содержатся только те элементы, которые имеют аллотропные формы? 1) CI, N, О
- 26. 5. Аллотропными модификациями являются: 1)азот и фосфор 2)кислород и озон 3) сера и селен 4) уран-235
- 27. 6. Графит и алмаз — это: 1)разные химические элементы 2)одно и то же вещество 3)аллотропные видоизменения
- 28. 7. Какие из перечисленных веществ являются различными аллотропными видоизменениями одного элемента? 1) кремний и кремнезем 2)
- 29. 8.Какой химический элемент не образует аллотропных модификаций? 1) Сера 2) Углерод 3) Фосфор 4) Азот
- 30. 9. Свойство химического элемента образовывать несколько простых веществ называют: 1)поливалентностью 2)гетерогенностью 3)аллотропией 4) изоморфизмом
- 31. 10. В порядке возрастания атомного радиуса химические элементы расположены в ряду: 1) N, Be, В, С
- 32. 11. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Al, Na,
- 33. 12. В ряду элементов: азот → кислород → фтор увеличивается: 1) атомный радиус 2) число неспаренных
- 34. 13. Наименьшей электроотрицательностью обладает элемент: Be В 3) С 4) N
- 35. 14. Наибольшей электроотрицательностью обладает элемент: 1) Si 2) P 3) S 4) CI
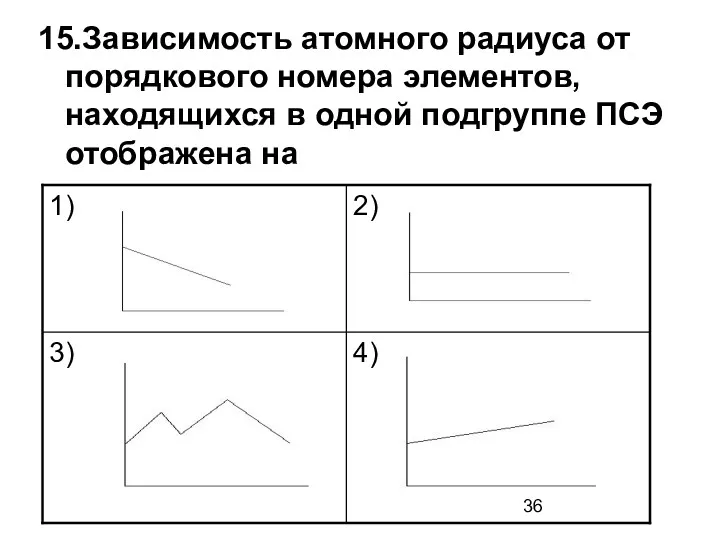
- 36. 15.Зависимость атомного радиуса от порядкового номера элементов, находящихся в одной подгруппе ПСЭ отображена на
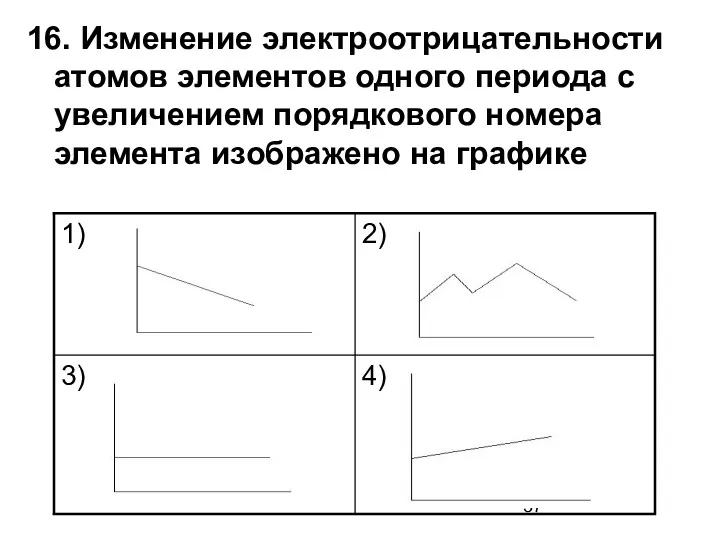
- 37. 16. Изменение электроотрицательности атомов элементов одного периода с увеличением порядкового номера элемента изображено на графике
- 38. 17. Увеличение электроотрицательности элементов, расположенных в одной группе, с уменьшением их порядковых номеров обусловлено 1) уменьшением
- 39. 18. Состав ядер изотопов 12С и 13С соответственно равен: 1) 12р+6n и 13p+7n 2) 12p+12n и
- 40. 19. Элементы расположены в порядке уменьшения их атомного радиуса 1) F→ Br → H → Cl
- 41. 20. Наименьший радиус имеет атом: 1) S 2) Al 3) Cl 4) Ar
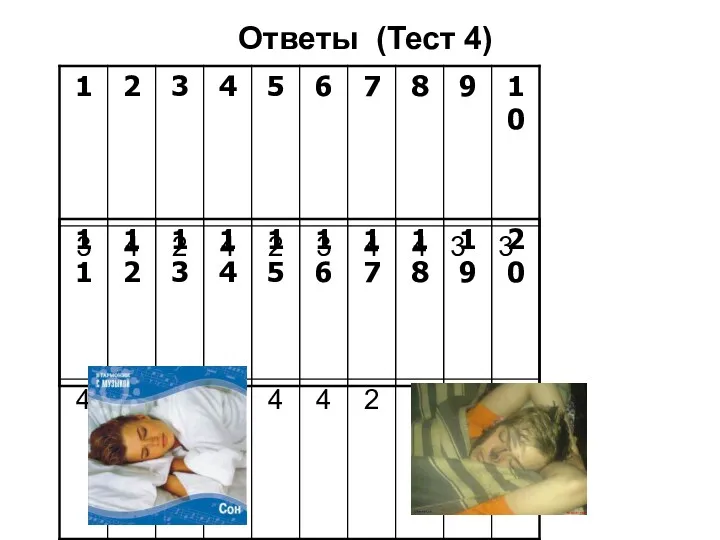
- 42. Ответы (Тест 4)
- 43. Тест 5 Изменение свойств элементов и их соединений в периодах и группах (несколько вариантов ответов)
- 45. В малых периодах расположены элементы (2 варианта ответа) только металлы только s- и р-семейств только групп
- 46. 2. Укажите физический смысл номера группы в периодической системе (2 варианта ответа): равен числу электронных слоев
- 47. 3. Неметаллические свойства атомов элементов постепенно нарастают в ряду: В, С, Si Si, C, B Si,
- 48. 4. В одном периоде находятся элементы: с подобными химическими свойствами атомов; с одинаковым числом валентных электронов
- 49. 5. Общую формулу летучих водородных соединений ЭН3 имеют элементы группы: II А III А IV А
- 50. 6. Какова общая формула летучих водородных соединений элементов VIА группы? НЭ Н2Э ЭН3 ЭН4
- 51. 7. Укажите общую формулу высших оксидов элементов IV А группы : ЭО Э2О3 ЭО2 Э2О5
- 52. 8. Общую формулу высших оксидов Э2О7 имеют элементы группы: III А IVA VA VII А
- 53. 9. Укажите символы элементов, формула высших оксидов которых Э2О3 (2 варианта ответа): Ca B Sc S
- 54. 10. В больших периодах расположены элементы (2 варианта ответа): только d- и f-семейств элементы s-, р.,
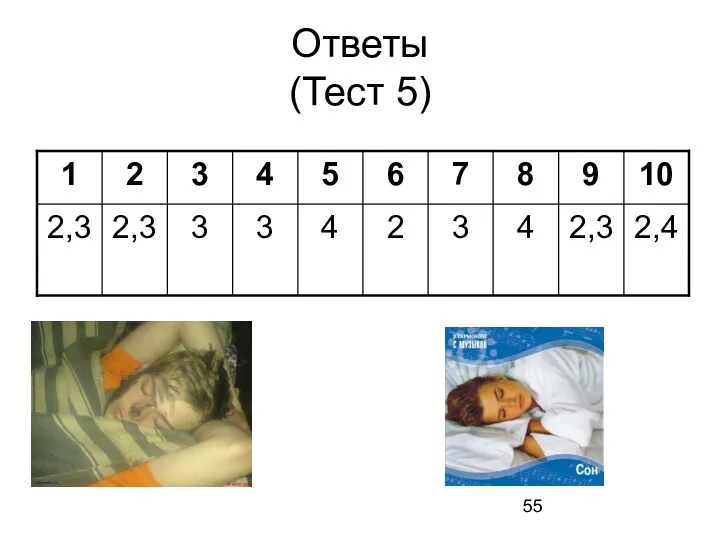
- 55. Ответы (Тест 5)
- 56. Тест 6 Изменение свойств элементов и их соединений в периодах и группах (один вариант ответа)
- 57. Укажите атомный номер элемента, образующего высший оксид и летучее водородное соединение состава Э2О5, ЭН3: 1 14
- 58. 2. Электроотрицательность последовательно возрастает в ряду атомов, символы которых: C, N, Si C, Si, N N,
- 59. 3. Укажите ряд, в котором символы элементов указаны в порядке возрастания энергии ионизации атомов: N, С,
- 60. 4. С последовательным возрастанием неметаллических свойств атомов химических элементов электроотрицательность: уменьшается не изменяется увеличивается изменяется периодически
- 61. 5. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами (n > 1): ns2 ns2np2
- 62. 6. Укажите электронную конфигурацию атома элемента с наиболее выраженными неметаллическими свойствами (n> 1): ns2np5 ns2np4 ns2np2
- 63. 7. Энергия сродства к электрону наибольшая у атомов химического элемента: Ве С N F
- 64. 8. Энергия сродства к электрону последовательно возрастает в ряду атомов элементов), химические символы которых: Р, S,
- 65. 9. Укажите электронную конфигурацию атома элемента с наиболее выраженными металлическими свойствами: 1s22s22p6 1s22s22p63s23p63d34s2 1s22s22p5 1s22s22p63s23p4
- 66. 10. Укажите электронную конфигурацию атома элемент с наиболее выраженными неметаллическими свойствам [Ne] 3s23p5 [Ne] 3s23р2 [Ne]3s23p4
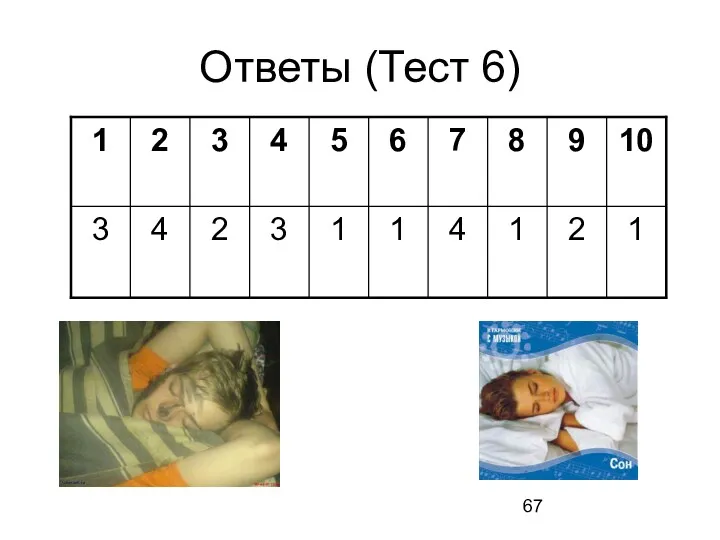
- 67. Ответы (Тест 6)
- 69. Скачать презентацию


















































 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей