Содержание
- 2. Особенностью гетерофазных процессов является перенос реагентов из одной фазы в другую за счет массопередачи. При этом,
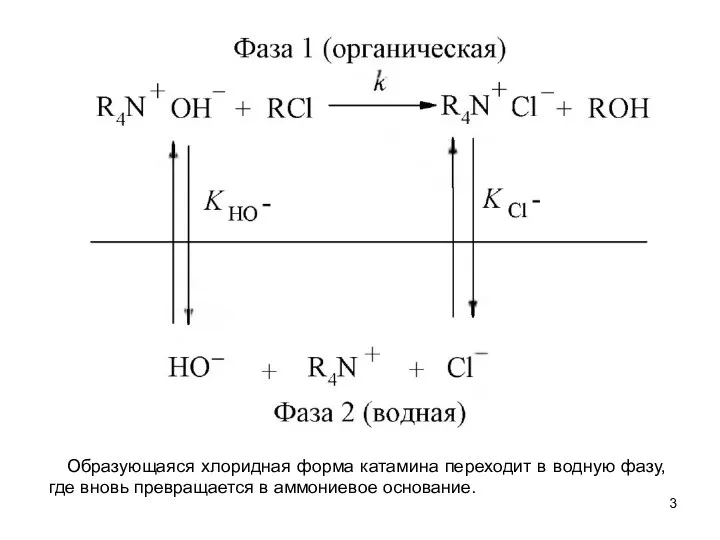
- 3. Образующаяся хлоридная форма катамина переходит в водную фазу, где вновь превращается в аммониевое основание.
- 4. В обычных условиях подобные реакции протекают в водной фазе, где растворимость хлорпроизводных мала и процесс идет
- 5. Четвертичные аммониевые соединения в водной фазе находятся в виде свободных ионов, а в органической - преимущественно
- 6. Здесь индексы 1 и 2 соответствуют органической и водной фазам, причем объем последней принят постоянным. Из
- 7. В качестве Кат МФП используют четвертичные аммониевые соли - триэтилбензиламмонийхлорид (ТЭБА), тетраалкиламмонийхлорид, краунэфиры (дибензо-18-краун-6, 15-краун-5), полиэтиленгликоли
- 8. ГЕТЕРОГЕННЫЙ КАТАЛИЗ Преимущества гетерогенного катализа перед гомогенным состоят в малом расходе катализатора, в снижении или полном
- 9. Гетерогенные катализаторы 1. Переходные металлы I подгруппы (Cu, Ag) и VIII группы (Fe, Ni, Co, Pt,
- 10. Гетерогенные катализаторы должны удовлетворять определенным требованиям, основные из которых следующие: 5. Бифункциональные катализаторы, являющиеся комбинацией оксида
- 11. Различают следующие виды промышленных катализаторов: В состав гетерогенных Кат часто вводят различные добавки, получившие название модификаторов
- 12. Al(NO3)3 + 3NH4OH = Al(OH)3 + 3NH4NO3 Все способы получения катализаторов делят на мокрые и сухие,
- 13. Для порошкообразных или специально измельченных материалов используют формование во влажном состоянии или таблетирование. В первом случае
- 14. Известны и другие способы приготовления Кат. Катализаторы на носителях готовят методом пропитки. Обычно носитель пропитывают несколько
- 15. Общие принципы гетерогенного катализа химических реакций 2. Принцип энергетического соответствия. Активному катализатору соответствует оптимальная величина координационной
- 16. Адсорбционные явления при катализе 3. Принципиальное единство явлений гетерогенного и гомогенного катализа. Принципиальный характер химического взаимодействия
- 17. Сила хемосорбционной связи зависит от химической природы катализатора, координационной ненасыщенности атомов на поверхности, пространственного расположения молекулы
- 18. 3) многоцентровые, включающие три, четыре и более атома катализатора. 2) мостиковая, связывающая два поверхностных атома; Относительные
- 19. где а - площадь, занимаемая одной молекулой; NL – число Лошмидта; V0 - мольный объем газа
- 20. ΔНадс - энтальпия адсорбции первого монослоя; rk - мольная теплота конденсации адсорбата. где Vадс - объем
- 21. Пористостью катализатора называют долю (или процент) пор в его зерне: где удельный объем пор Vп определяется
- 22. - силами притяжения и отталкивания между молекулами или атомами, адсорбированными на соседних центрах, можно пренебречь; -
- 23. где kадс и kдес - константы скорости адсорбции и десорбции. Кинетический вывод изотермы адсорбции Коэффициент b
- 24. Для случая адсорбции смеси веществ доля поверхности, занятая i-м веществом, описывается формулой Из уравнения (7) следует,
- 25. Механизм гетерогенно-каталитических реакций Поэтому была разработана теория адсорбции на неоднородной поверхности (Рогинский). В основу ее положено
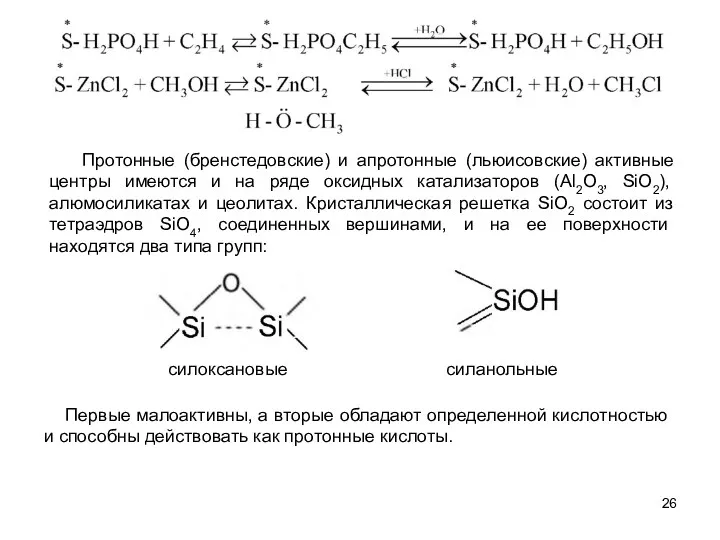
- 26. силоксановые Протонные (бренстедовские) и апротонные (льюисовские) активные центры имеются и на ряде оксидных катализаторов (Аl2О3, SiO2),
- 27. На γ-Al2O3, часто используемом в качестве катализатора и носителя, имеется несколько типов ОН-групп, различающихся окружением и
- 28. Соотношение активных центров двух типов и их кислотность зависят от соотношения Al/Si и степени гидратации поверхности.
- 30. Механизм дегидратации спиртов на Аl2О3 состоит в первичном образовании аддукта и отщеплении протона с участием соседнего
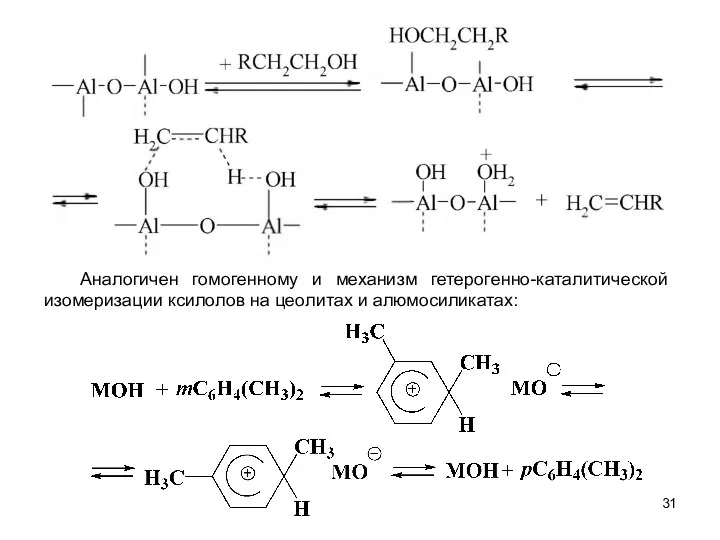
- 31. Аналогичен гомогенному и механизм гетерогенно-каталитической изомеризации ксилолов на цеолитах и алюмосиликатах:
- 32. Для разных реакций оптимальны активные центры бренстедовского или льюисовского типа либо центры, обладающие разной кислотностью. Так,
- 33. причем d-электроны металла частично смещаются к водороду (Mδ+-H δ- ) и образуется аддукт, который аналогичен гидридным
- 34. Оксид углерода взаимодействует с переходными металлами и их ионами за счет d-орбитали металла или иона и
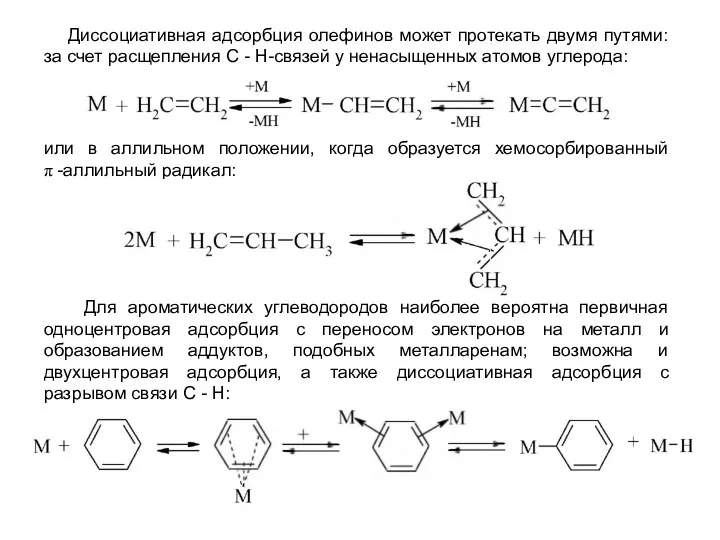
- 35. Далее может протекать диссоциация с образованием поверхностных карбенов и более ненасыщенных частиц: Олефины дают с переходными
- 36. Для ароматических углеводородов наиболее вероятна первичная одноцентровая адсорбция с переносом электронов на металл и образованием аддуктов,
- 38. Скачать презентацию































 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті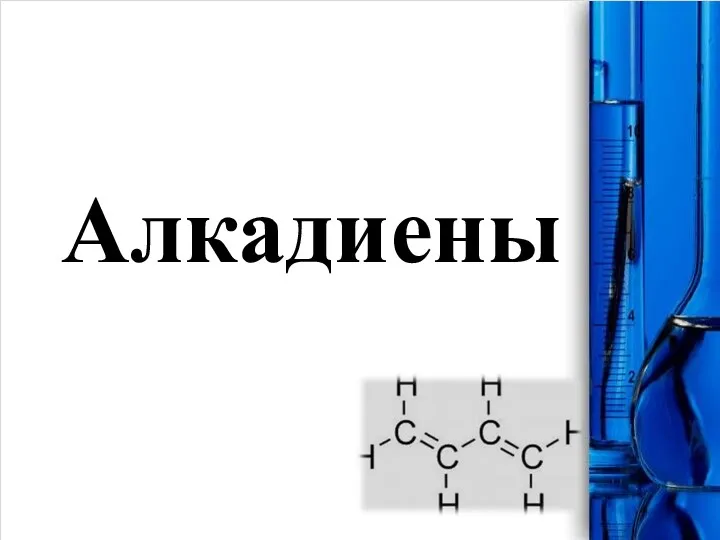 Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё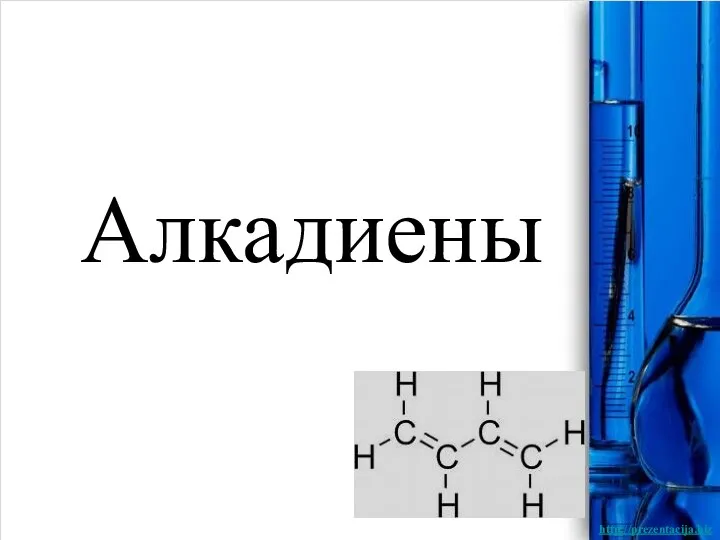 Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1