Содержание
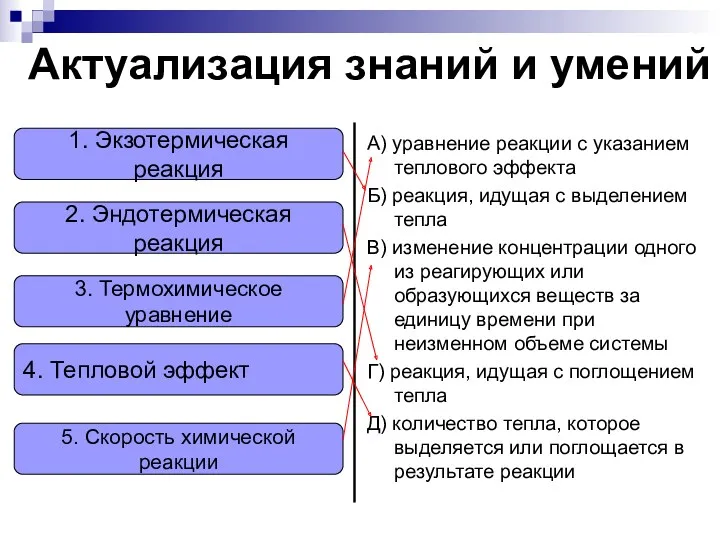
- 2. Актуализация знаний и умений А) уравнение реакции с указанием теплового эффекта Б) реакция, идущая с выделением
- 3. Химическое равновесие. Принцип Ле Шателье Цель урока: познакомиться с понятием «химическое равновесие», принципом Ле Шателье, а
- 4. Задачи урока: 1) сформировать знания о химическом равновесии - состоянии, которое неизбежно наступает при протекании обратимой
- 5. Необратимые реакции BaCl2 + H2SO4 → BaSO4 + 2HCl исходные вещества продукты реакции Необратимые реакции -
- 6. Обратимые реакции N2 + 3H2 2NH3 исходные вещества продукты реакции Обратимые реакции - это химические реакции,
- 7. ν1 SO2 + H2O H2SO3 ν2 где: ν1 – прямая реакция (идет в сторону образования продуктов
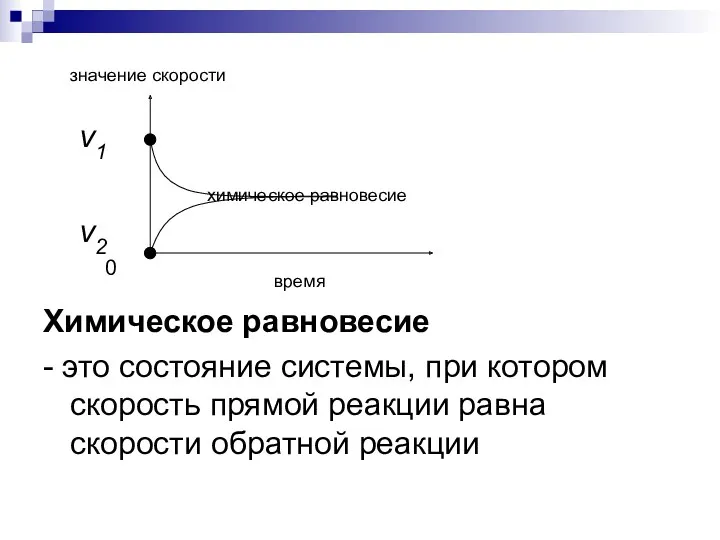
- 8. значение скорости ν1 химическое равновесие ν2 0 время Химическое равновесие - это состояние системы, при котором
- 9. Принцип Ле Шателье при изменении внешних условий химическое равновесие смещается в строну той реакции, которая ослабляет
- 10. Влияние температуры 2SO2 + O2 2SO3 + Q (2SO3 2SO2 + O2 – Q)
- 11. Влияние давления 2SO2 + O2 2SO3 + Q 2V + 1V 2V
- 12. Влияние концентрации
- 13. aA + bB dD + fF [D]d . [F]f Kp = ----------- [A]a . [B]b где:
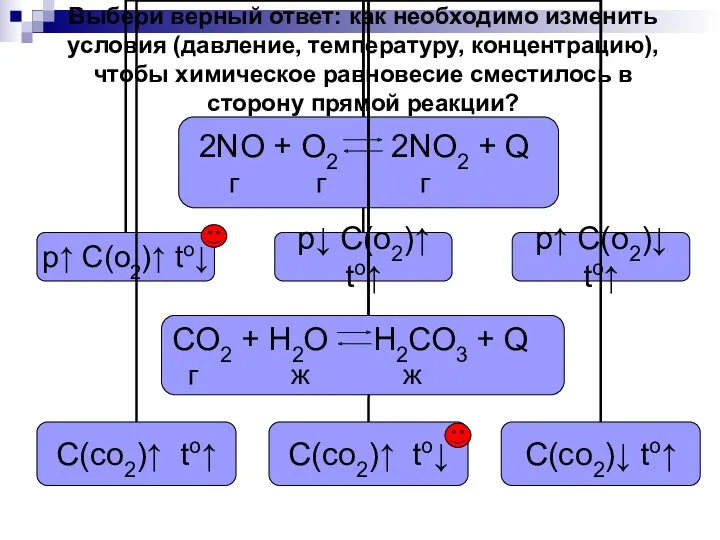
- 14. Выбери верный ответ: как необходимо изменить условия (давление, температуру, концентрацию), чтобы химическое равновесие сместилось в сторону
- 16. Скачать презентацию









![aA + bB dD + fF [D]d . [F]f Kp](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405583/slide-12.jpg)
 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)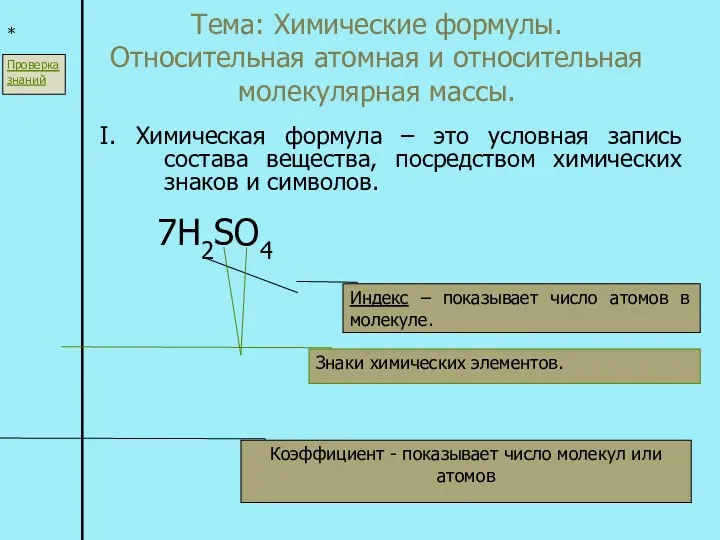 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны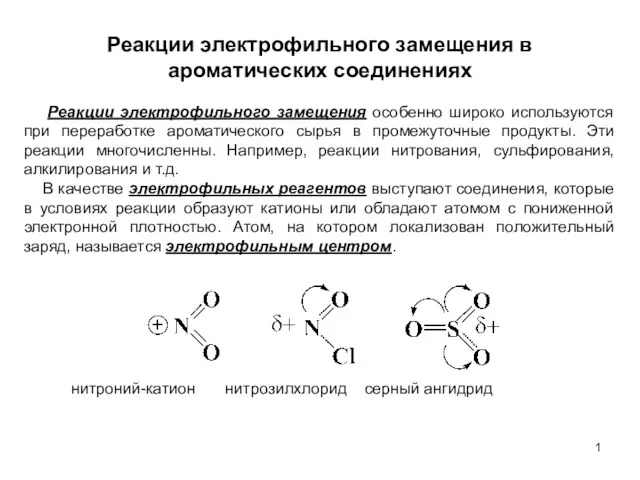 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования