Содержание
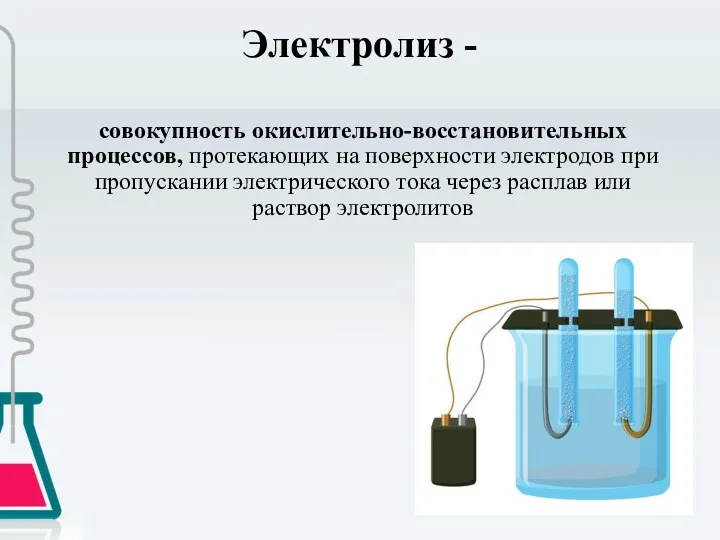
- 2. Электролиз - совокупность окислительно-восстановительных процессов, протекающих на поверхности электродов при пропускании электрического тока через расплав или
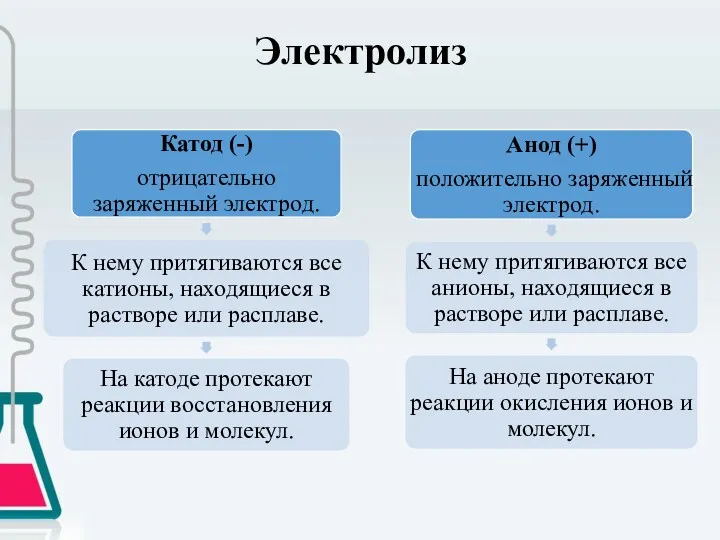
- 3. Электролиз
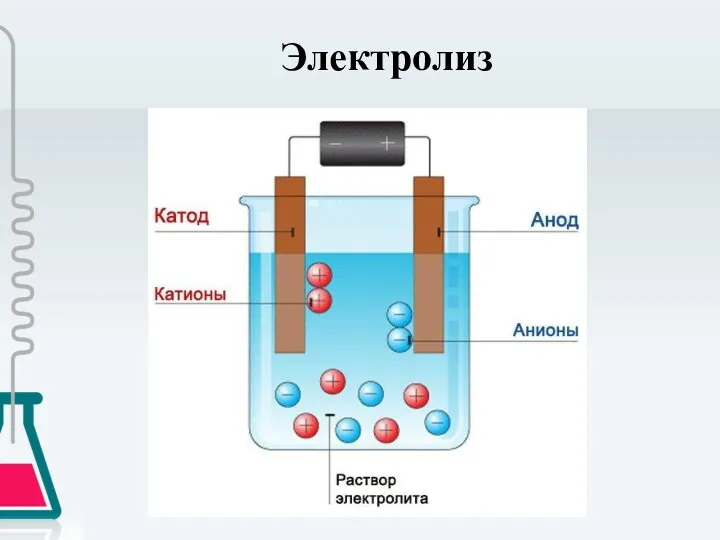
- 4. Электролиз
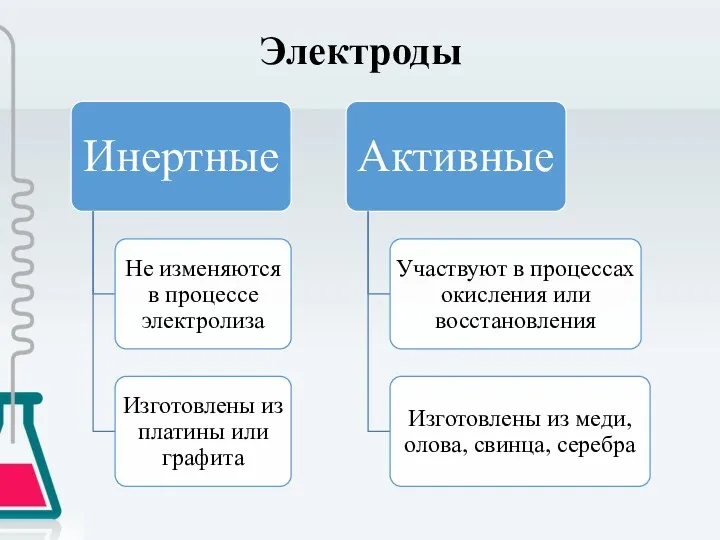
- 5. Электроды
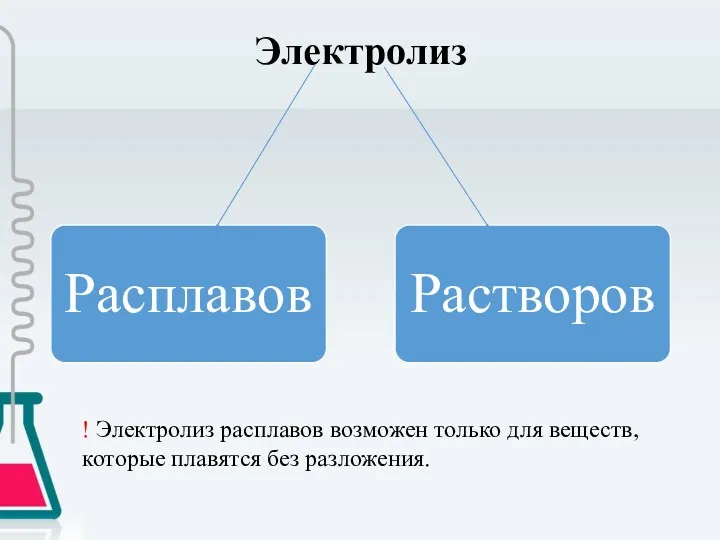
- 6. Электролиз ! Электролиз расплавов возможен только для веществ, которые плавятся без разложения.
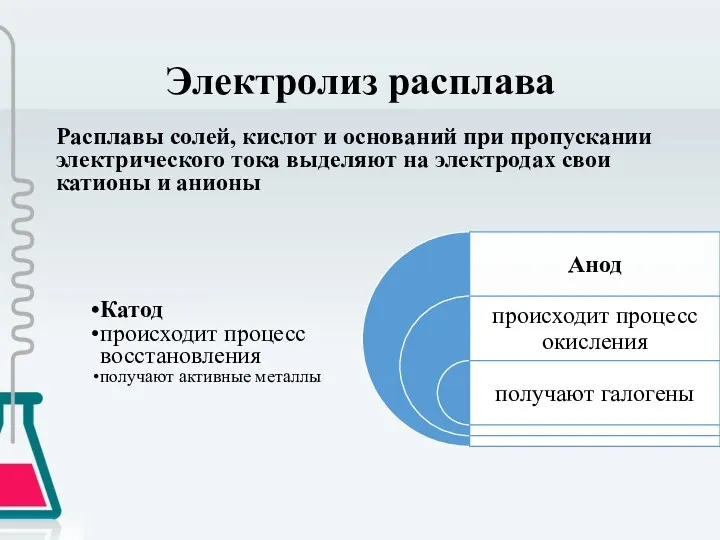
- 7. Электролиз расплава Расплавы солей, кислот и оснований при пропускании электрического тока выделяют на электродах свои катионы
- 8. Электролиз расплава NaCl Na+ + Cl- При пропускании электрического тока на катоде протекает восстановление ионов натрия
- 9. Электролиз расплава Na2SO4 2Na+ + SO42- Катод (-): 2Na+ + 2ē → 2Na0 Анод (+): SO42-
- 10. Электролиз воды Приводит к выделению молекул водорода H20 на катоде и молекул O20 на аноде. Водорода
- 11. Электролиз растворов Правила электролиза строго определяют продукты, образующиеся на катоде или аноде в результате электролиза раствора
- 12. Катодные правила Если на катоде находятся катионы H+ (из воды) и катионы активного металла (расположены в
- 13. Катодные правила 3) Если на катоде находятся катионы водорода и катионы металла средней активности (металлы от
- 14. Анодные правила Если на аноде находятся анионы бескислородной кислоты (Cl-, Br-, I-, S2-) и гидроксид-анионы, то
- 15. Анодные правила 3) Если на аноде находятся гидроксид-анионы, то они подвергаются окислению с образованием молекул O2.
- 16. Электролиз раствора NaCl NaCl Na+ + Cl- H2O H+ + OH- Катод (-): 2H2O + 2ē
- 17. Электролиз раствора CuSO4 CuSO4 Cu2+ + SO42- H2O H+ + OH- Катод (-): Cu2+ + 2ē
- 18. Электролиз раствора AgCl AgCl Ag+ + Cl- H2O H+ + OH- Катод (-): Ag+ + 1ē
- 19. Применение электролиза
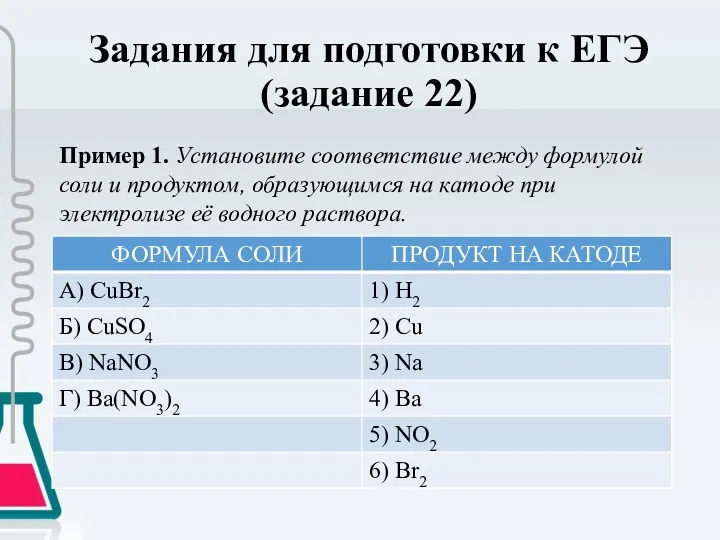
- 20. Задания для подготовки к ЕГЭ (задание 22) Пример 1. Установите соответствие между формулой соли и продуктом,
- 21. Задания для подготовки к ЕГЭ (задание 22) Решение. Напомним, что на катоде протекает процесс восстановления (присоединения
- 22. Задания для подготовки к ЕГЭ (задание 22) Ответ:
- 23. Задания для подготовки к ЕГЭ (задание 22) Пример 2. Установите соответствие между формулой соли и продуктом,
- 24. Задания для самостоятельного решения Задание 3. Установите соответствие между формулой вещества и продуктами электролиза водного раствора
- 26. Скачать презентацию
















 Неметаллические материалы
Неметаллические материалы Кислород
Кислород Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Основания. 8 класс
Основания. 8 класс Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Observing change. Chemical reactions
Observing change. Chemical reactions Виды химической связи
Виды химической связи Составление формул химических соединений
Составление формул химических соединений Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Элементы VIА группы
Элементы VIА группы Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Амины
Амины Обмен липидов
Обмен липидов Кислоты, их классификация и свойства. 8 класс
Кислоты, их классификация и свойства. 8 класс Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Гідроліз солей
Гідроліз солей Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Материаловедение. Химические волокна
Материаловедение. Химические волокна Chemical Bonding I: Basic Concepts
Chemical Bonding I: Basic Concepts Тепловой эффект химической реакции
Тепловой эффект химической реакции Analytical chemistry methods
Analytical chemistry methods Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Азот, строение, свойства. Круговорот азота в природе
Азот, строение, свойства. Круговорот азота в природе Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии