Содержание
- 2. Атомы соединяются друг с другом с образованием простых и сложных веществ за счет возникновения между ними
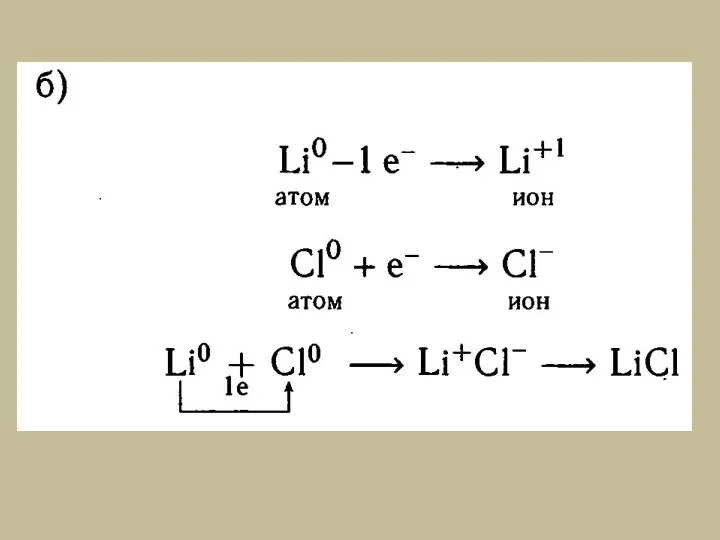
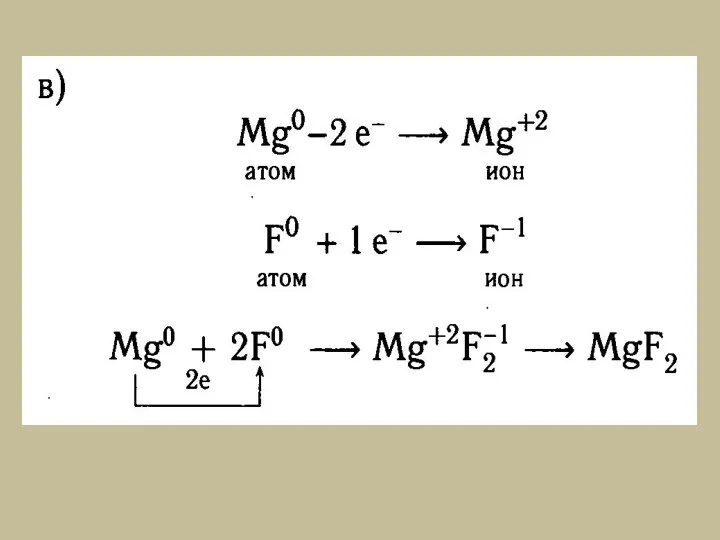
- 3. I. Ионная связь – химическая связь образуется при взаимодействии атомов с большой разностью значений электроотрицательности, при
- 5. Схемы образования ионной связи между атомами химических элементов
- 8. II. Ковалентная (атомная) связь – химическая связь образует-ся между атомами за счет образования общих электронных пар
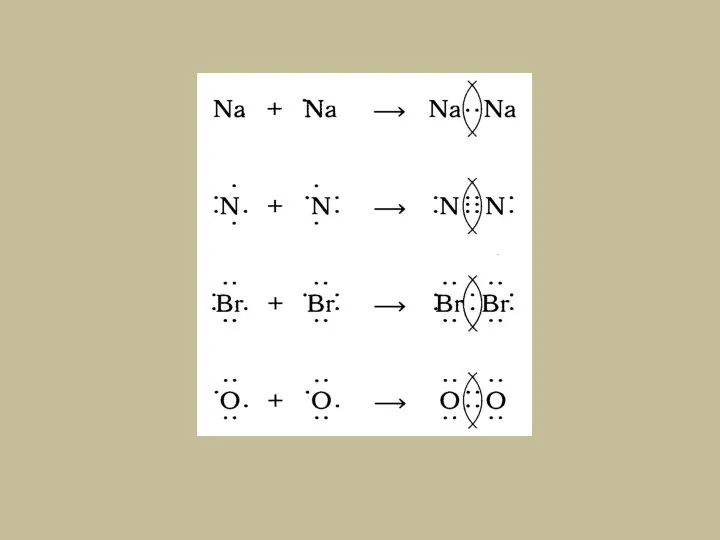
- 9. а)Ковалентная неполярная связь – образуется при взаимодействии атомов одного химического элемента (простые вещества) или элементов-неметаллов с
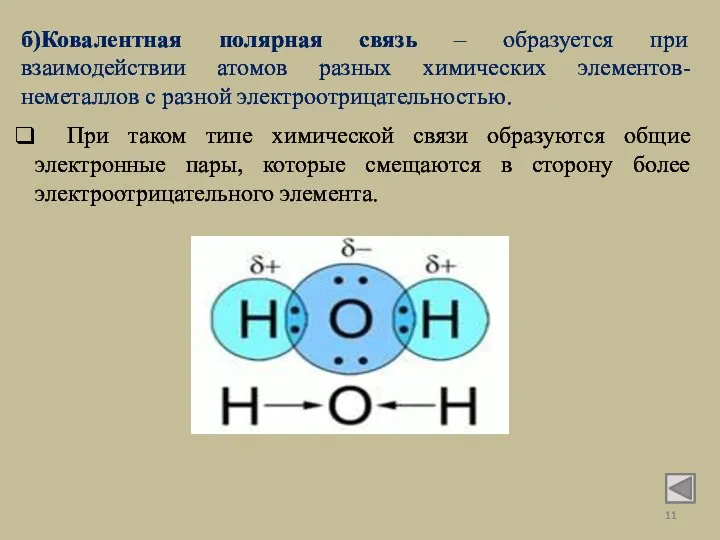
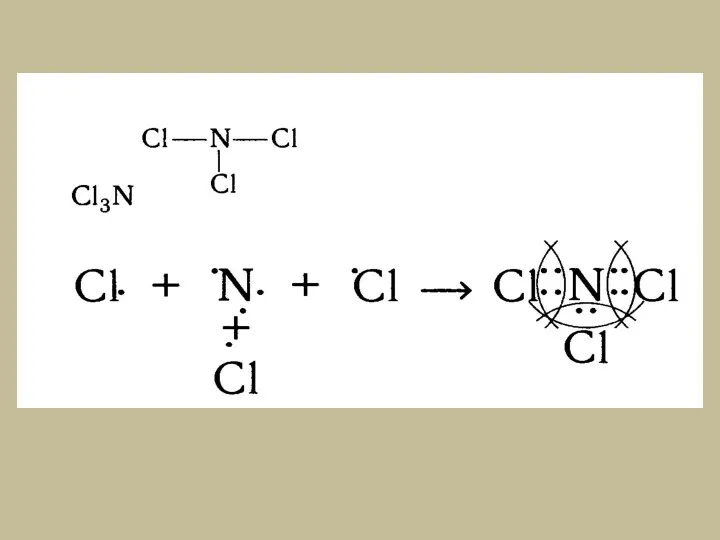
- 11. б)Ковалентная полярная связь – образуется при взаимодействии атомов разных химических элементов-неметаллов с разной электроотрицательностью. При таком
- 15. в)Донорно-акцепторная связь – образуется при взаимодействии неподеленной электронной пары атома одного химического элемента (донора) и свободной
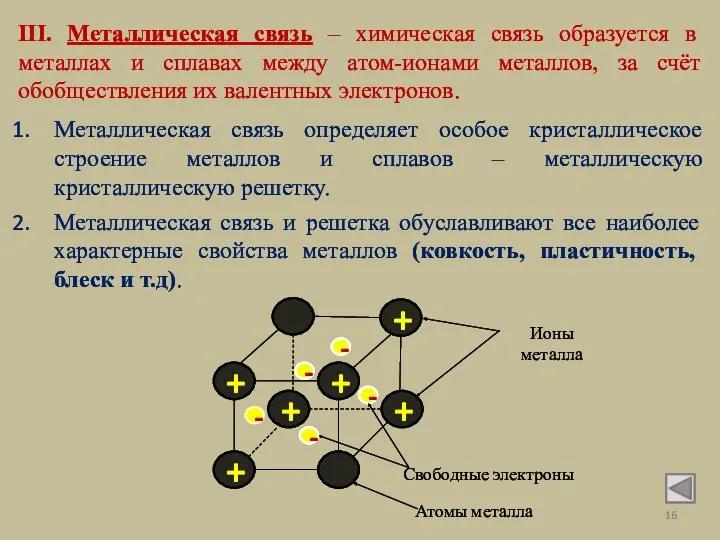
- 16. III. Металлическая связь – химическая связь образуется в металлах и сплавах между атом-ионами металлов, за счёт
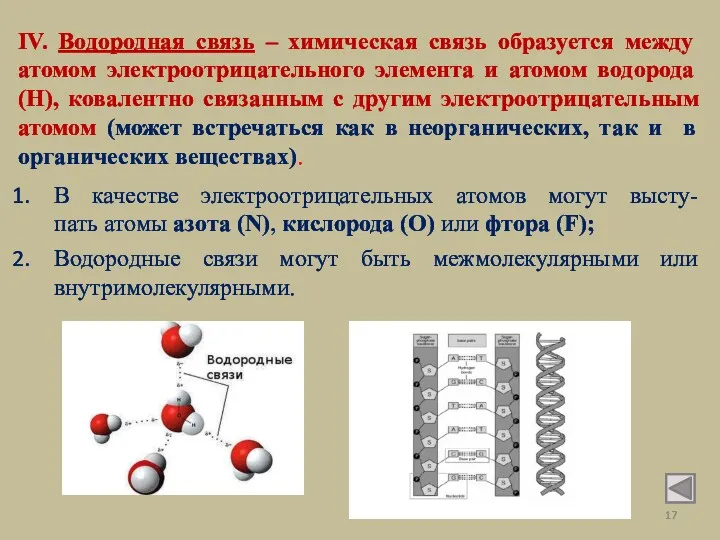
- 17. IV. Водородная связь – химическая связь образуется между атомом электроотрицательного элемента и атомом водорода (Н), ковалентно
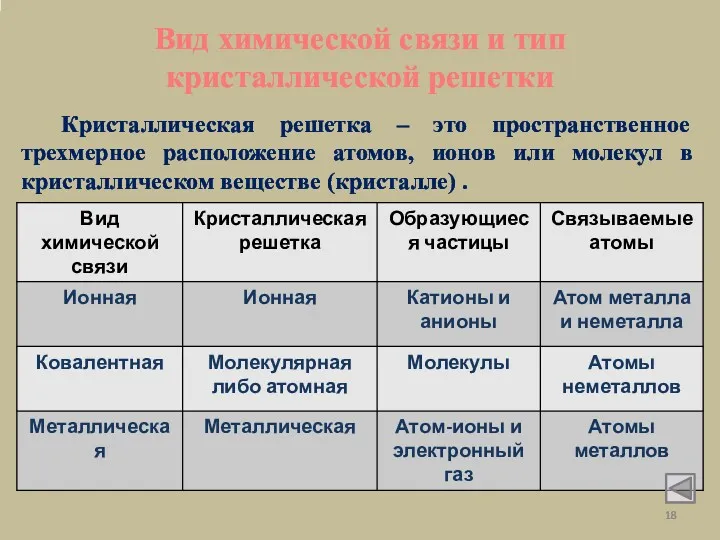
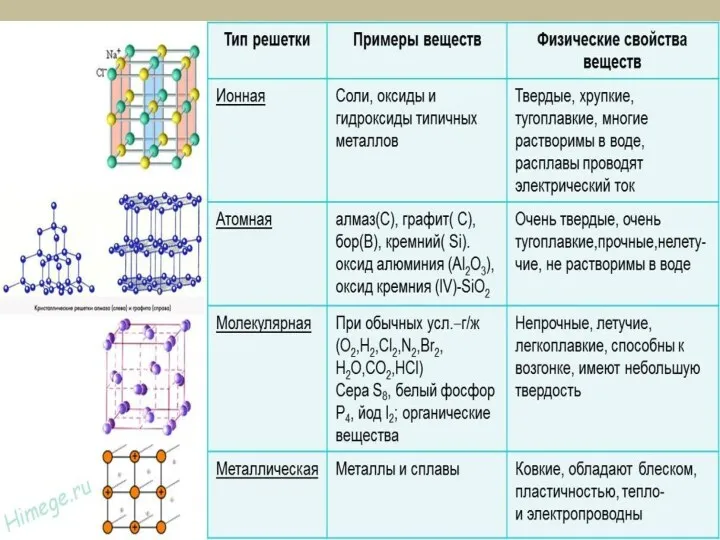
- 18. Вид химической связи и тип кристаллической решетки Кристаллическая решетка – это пространственное трехмерное расположение атомов, ионов
- 21. Скачать презентацию






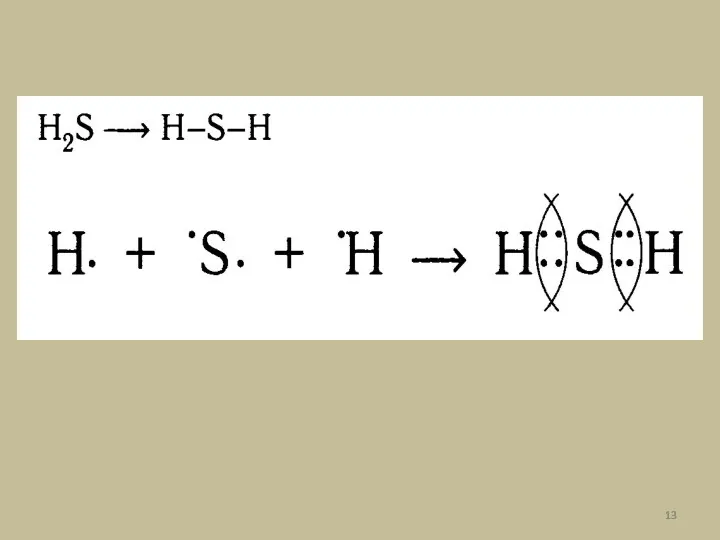


 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей