Содержание
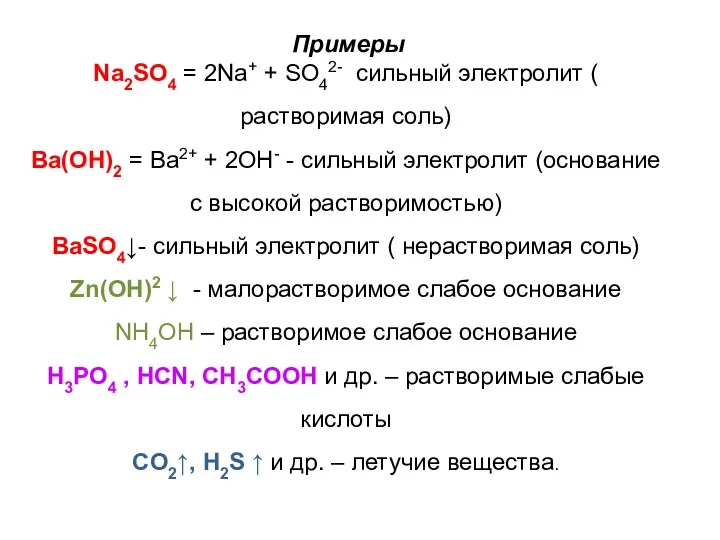
- 2. Примеры Na2SO4 = 2Na+ + SO42- сильный электролит ( растворимая соль) Ba(OH)2 = Ba2+ + 2OH-
- 3. Реакции в растворах электролитов протекают в направлении связывания ионов. Существует несколько форм связывания ионов: 1. Образование
- 4. 1. Образование осадка: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl. Ba2++2Cl- + 2Na++ SO42-→ BaSO4↓ +
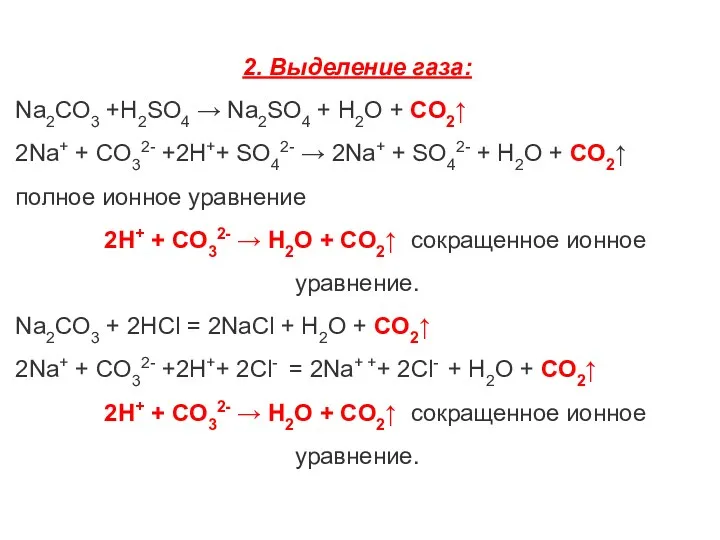
- 5. 2. Выделение газа: Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2↑ 2Na+ + CO32- +2H++ SO42-
- 6. 3. Образование слабого электролита: Реакция нейтрализации KOH + HBr → KBr + H2O K+ + OH-
- 7. 3. Образование слабого электролита: Другие растворимые слабые электролиты • Слабые растворимые кислоты NaNO2 + HCl =
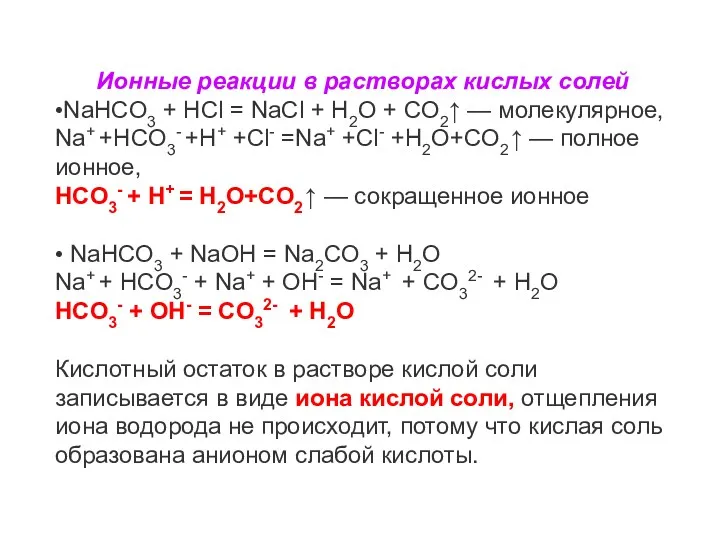
- 8. Ионные реакции в растворах кислых солей •NaHCO3 + HCl = NaCl + H2O + CO2↑ —
- 9. Ионные реакции в растворах основных солей Основные соли, как правило, нерастворимы в воде При ступенчатом взаимодействии
- 10. Реакции амфотерных гидроксидов Zn(OH)2+NaOH = Na2[Zn(OH)4] Ионное уравнение Zn(OH)2+ 2Na+ + 2OH- = 2Na+ + [Zn(OH)4]2-
- 11. Реакции амфотерных гидроксидов с кислотами Zn(OH)2 + 2HCl = ZnCl2+H2O Это, в принципе, реакция нейтрализации. Однако,
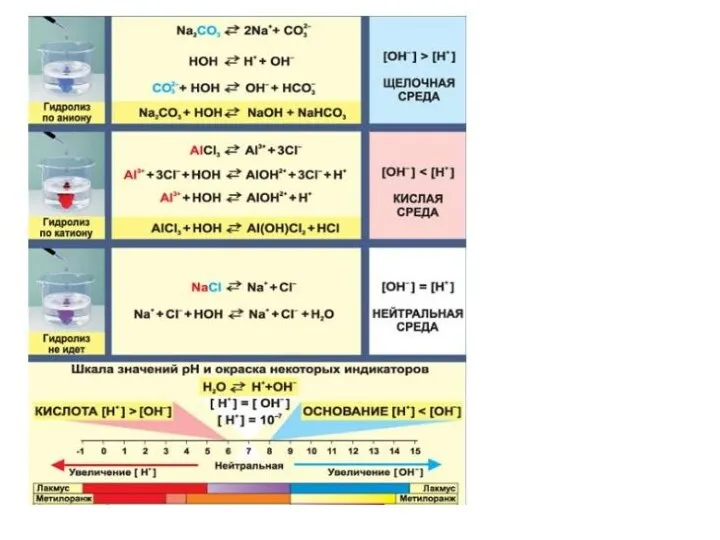
- 12. Гидролиз солей Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды.
- 13. В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей. Соли,
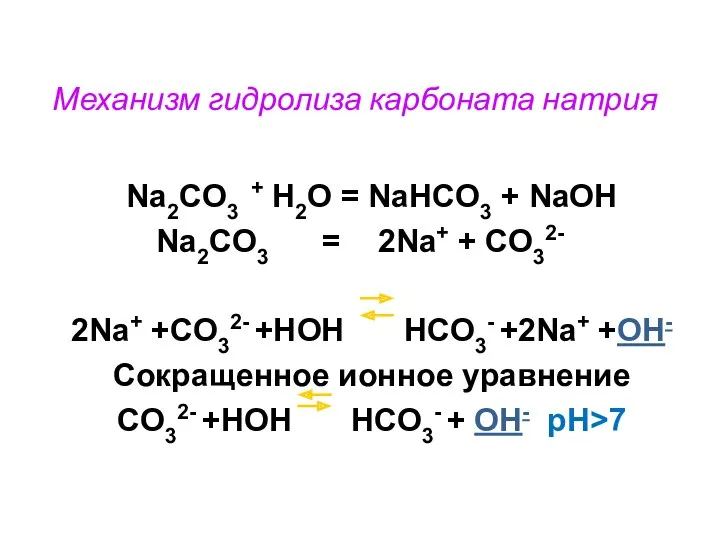
- 14. Механизм гидролиза карбоната натрия Na2CO3 + H2O = NaHCO3 + NaOH Na2CO3 = 2Na+ + CO32-
- 15. FeCl2 + H2O ↔ FeOHCl + HCl FeCl2 ↔ Fe2+ + 2Cl- Fe2+ + HOH ↔
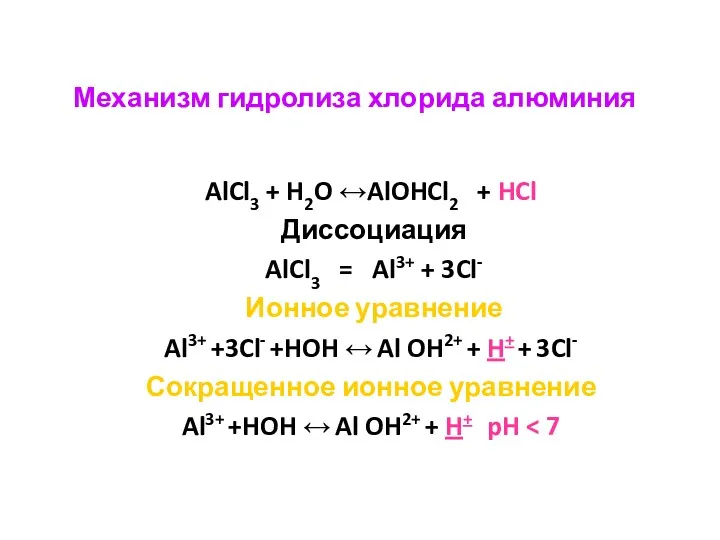
- 16. Механизм гидролиза хлорида алюминия AlCl3 + H2O ↔AlOHCl2 + HCl Диссоциация AlCl3 = Al3+ + 3Cl-
- 17. 4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу. К таким солям
- 18. Для большинства солей гидролиз обратимый процесс. Однако есть соли, продукты гидролиза которых выводятся из сферы реакции,
- 20. Степень гидролиза зависит от: -природы соли, -температуры, - концентрации соли Обычно степень гидролиза менее 5%, но
- 21. Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций
- 22. В общем случае: Для соли, образованной слабой кислотой и сильным основанием: — константа диссоциации слабой кислоты,
- 25. Скачать презентацию





![Реакции амфотерных гидроксидов Zn(OH)2+NaOH = Na2[Zn(OH)4] Ионное уравнение Zn(OH)2+ 2Na+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/587492/slide-9.jpg)










 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки