Химические свойства. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства
кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl -> Cl- [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют функциональные производные:
а) соли
H2N–CH2–COOH + NaOH -> H2N–CH2–COO- Na+ + H2O
б) сложные эфиры
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
Межмолекулярное взаимодействие a-аминокислот приводит к образованию пептидов. При взаимодействии двух a-аминокислот образуется дипептид.
Межмолекулярное взаимодействие трех a-аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Свойства аминокислот. Слайд№6







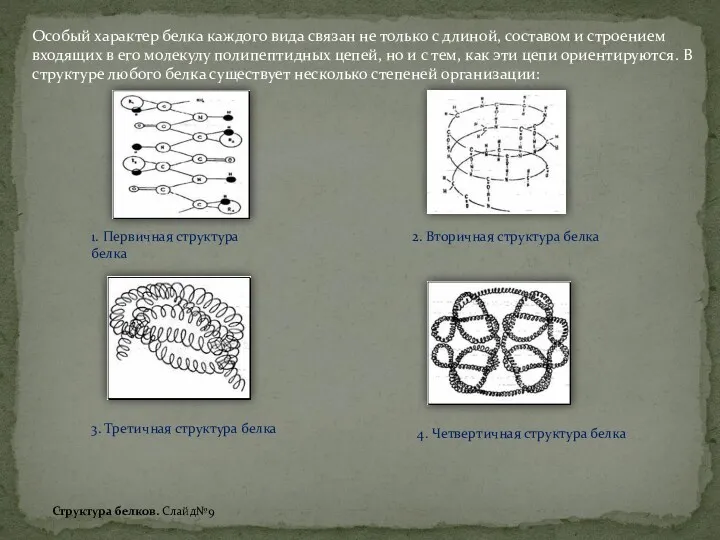
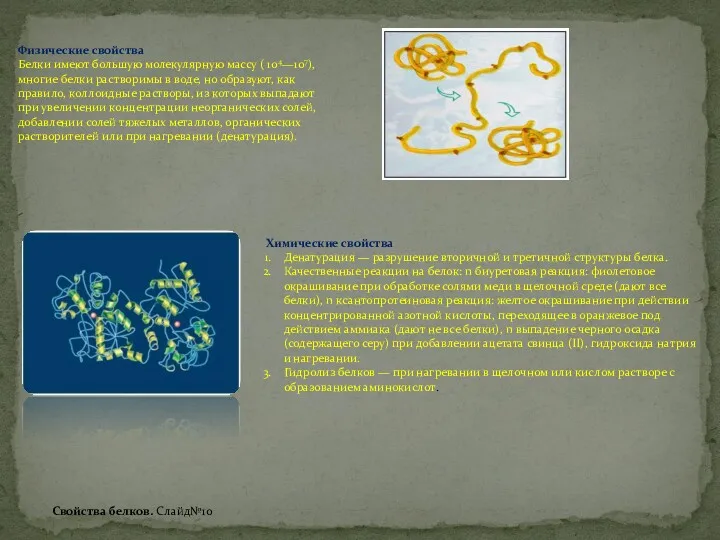
 Общая характеристика неметаллов
Общая характеристика неметаллов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Аморфные сплавы
Аморфные сплавы Электролиз. Классификация
Электролиз. Классификация Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы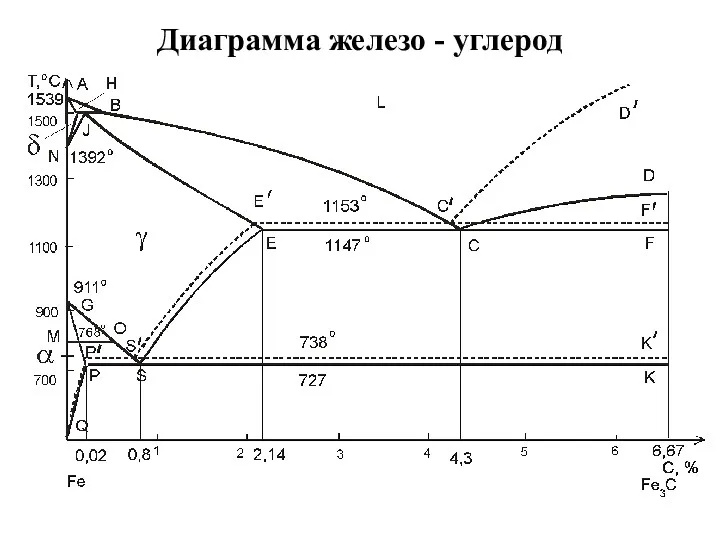 Диаграмма железо - углерод
Диаграмма железо - углерод Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Alkynes
Alkynes Металлическая связь
Металлическая связь Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Комплексные соединения
Комплексные соединения Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів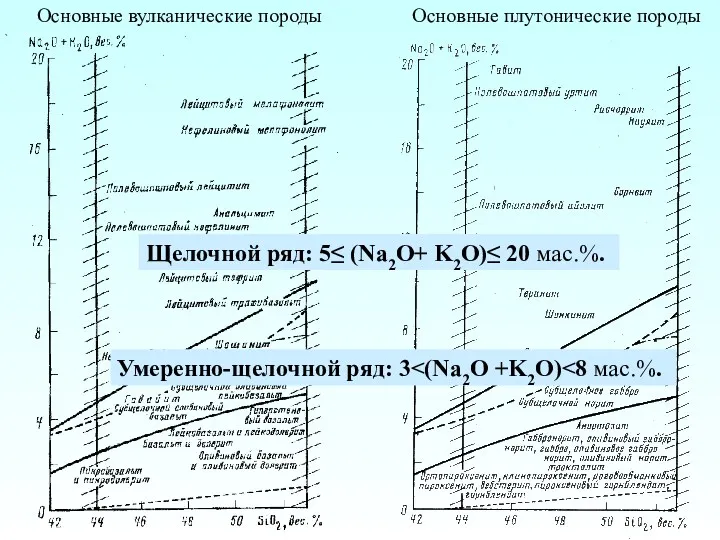 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Технология промышленных газов
Технология промышленных газов Кислотно-основное титрование
Кислотно-основное титрование Химические свойства алкенов
Химические свойства алкенов Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Анілін. Фізичні властивості
Анілін. Фізичні властивості Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества 20230419_oksidy
20230419_oksidy