Содержание
- 2. Атомы металлов легко отдают электроны т. к. у них большой атомный радиус и мало электронов на
- 3. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ - связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
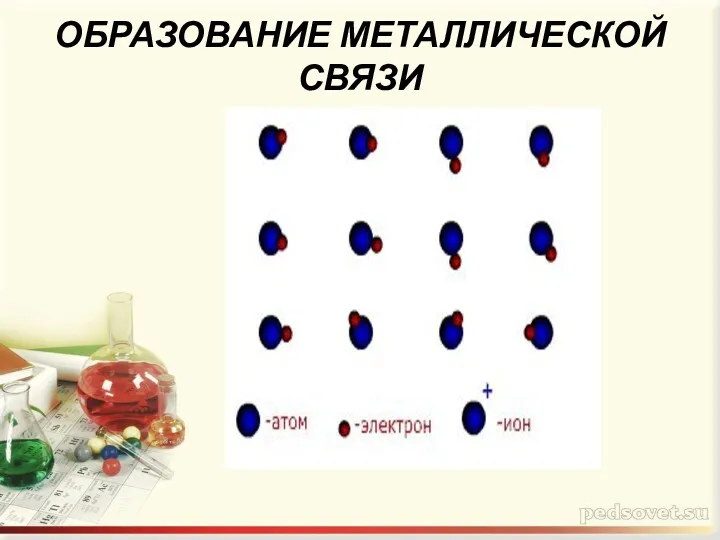
- 4. ОБРАЗОВАНИЕ МЕТАЛЛИЧЕСКОЙ СВЯЗИ
- 5. Оторвавшиеся электроны перемещаются от одного иона к другому , связывая их в единое целое Небольшое количество
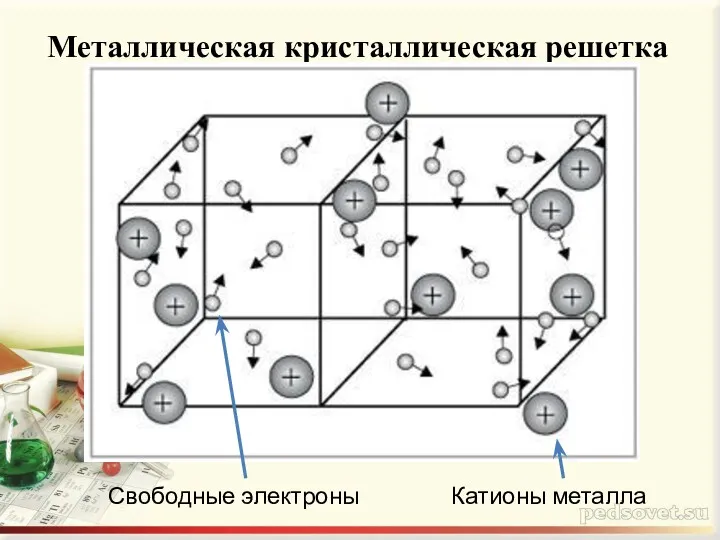
- 6. Металлическая кристаллическая решетка Свободные электроны Катионы металла
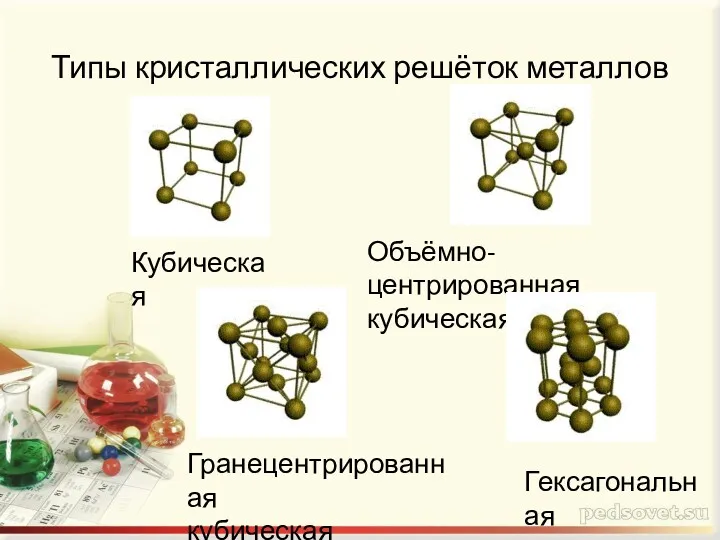
- 7. Типы кристаллических решёток металлов Кубическая Объёмно-центрированная кубическая Гранецентрированная кубическая Гексагональная
- 8. Металлическая связь характерна для металлов и их сплавов в твёрдом и жидком состоянии
- 9. Металлическая связь характеризуется: Небольшим числом валентных электронов Она слабее ковалентной и ионной связи Она определяет все
- 10. Металлический блеск Теплопроводность Электропроводность Ковкость (пластичность) Наличием свободных электронов объясняются физические свойства металлов
- 11. Металлическая связь похожа на Ионную связь (происходит образование катионов, ē связывают ионы Ме за счет электростатического
- 12. Металлическая химическая связь характерна для металлов и их сплавов Металлическая связь как и ковалентная образуется за
- 13. В металлической связи как и в ионной образуются ионы. Основа химической связи одна - электростатическое взаимодействие
- 16. Скачать презентацию










 Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования The halogens
The halogens Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Крахмал. Строение вещества
Крахмал. Строение вещества Alkynes
Alkynes Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Природные источники углеводородов
Природные источники углеводородов Топливо. Виды топлива
Топливо. Виды топлива p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Ионные уравнения реакции
Ионные уравнения реакции Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук Гидролиз. Классификация солей
Гидролиз. Классификация солей Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Heavy metals
Heavy metals Lipid metabolism
Lipid metabolism Основные разделы химии
Основные разделы химии Кислоты
Кислоты Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Tungsten. (Вольфрам)
Tungsten. (Вольфрам)