Содержание
- 3. Основные разделы химии Общая химия и неорганическая химия Физическая и коллоидная химия Аналитическая химия Органическая химия
- 4. Химический состав организма Вода – 60-65 % (≈ 2/3 от массы тела) Органические соединения - 30-32
- 5. Органические соединения 1. Белки 2. Нуклеиновые кислоты 3. Углеводы 4. Липиды
- 6. Структурная (строительная, пластическая) функция Эта функция заключается в том, белки являются универсальным строительным материалом, из которого
- 7. Каталитическая функция В организме имеются особые белки, являющиеся катализаторами химических реакций. Такие белки получили название ферменты
- 8. Сократительная функция В основе всех форм движения и, в первую очередь, мышечного сокращения и расслабления лежит
- 9. Регуляторная функция Белки обладают амфотерностью и могут взаимодействовать как с кислотами, так и с основаниями. Поэтому
- 10. Транспортная функция Белковые молекулы имеют большой размер, хорошо растворимы в воде и, перемещаясь по водным пространствам
- 11. Защитная функция Белки выполняют защитную функцию, участвуя в обеспечении иммунитета; К защитной функции относится участие белков
- 12. Энергетическая функция Окисление белков, как и всех других органических соединений, сопровождается выделением энергии; Однако роль белков
- 13. Исходя из важнейшей биологической роли белков в организме, их еще называют протеинами (от греч. рroteus –
- 14. Белки - высокомолекулярные азотсодержащие соединения, состоящие из аминокислот; В одну молекулу белков входят десятки, сотни, тысячи
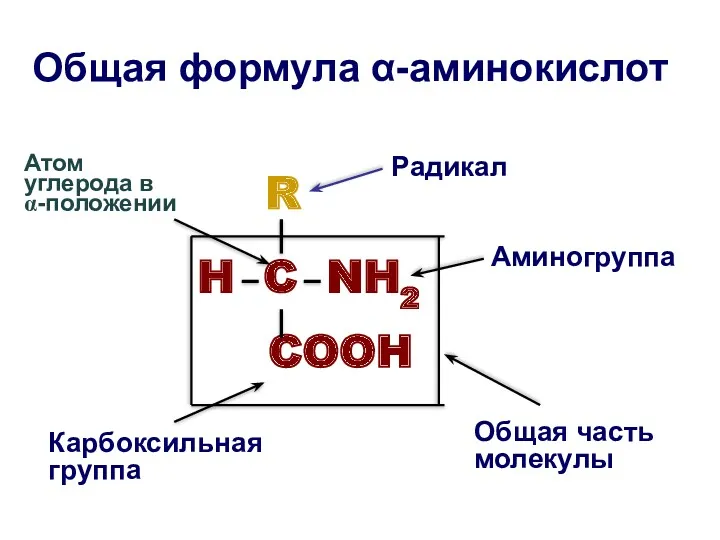
- 15. Общая формула α-аминокислот R H C NH2 COOH Общая часть молекулы Радикал Аминогруппа Карбоксильная группа Атом
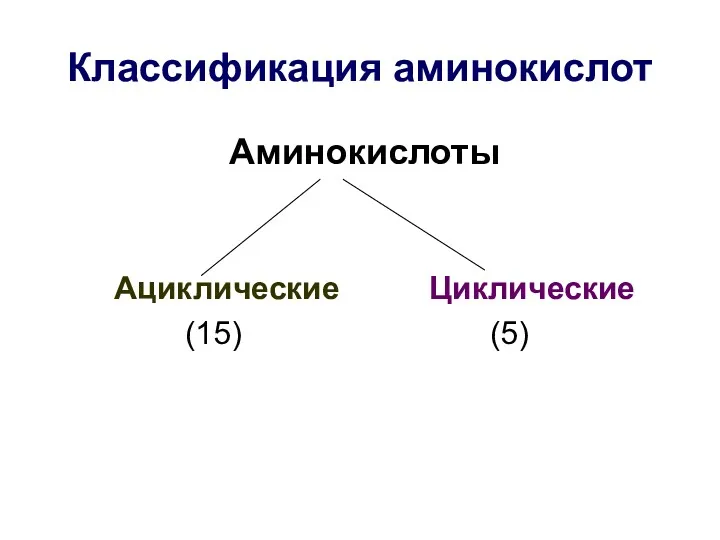
- 16. Классификация аминокислот Аминокислоты Ациклические Циклические (15) (5)
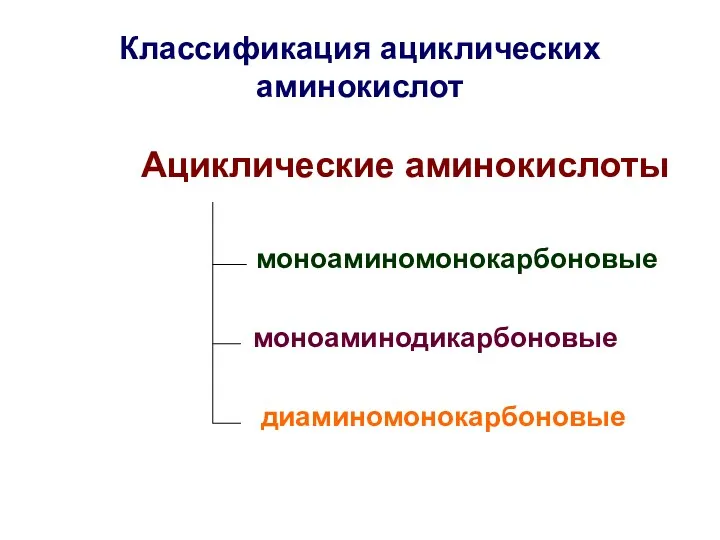
- 17. Классификация ациклических аминокислот Ациклические аминокислоты моноаминомонокарбоновые моноаминодикарбоновые диаминомонокарбоновые
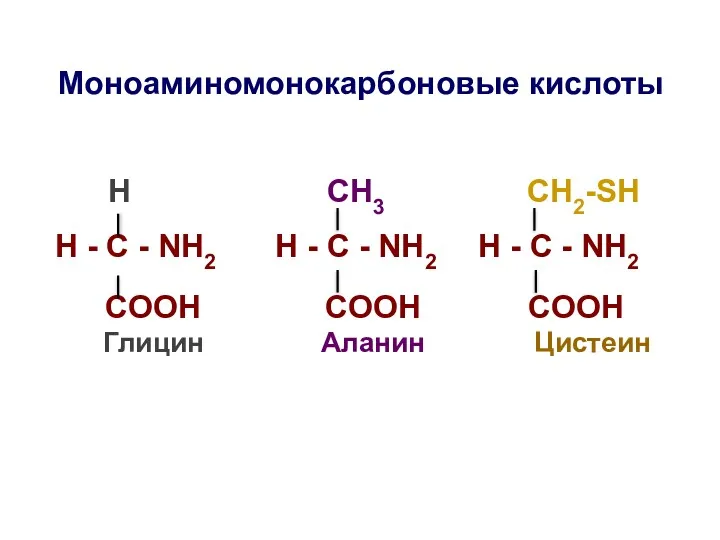
- 18. Моноаминомонокарбоновые кислоты H СН3 СН2-SH H - C - NH2 H - C - NH2 H
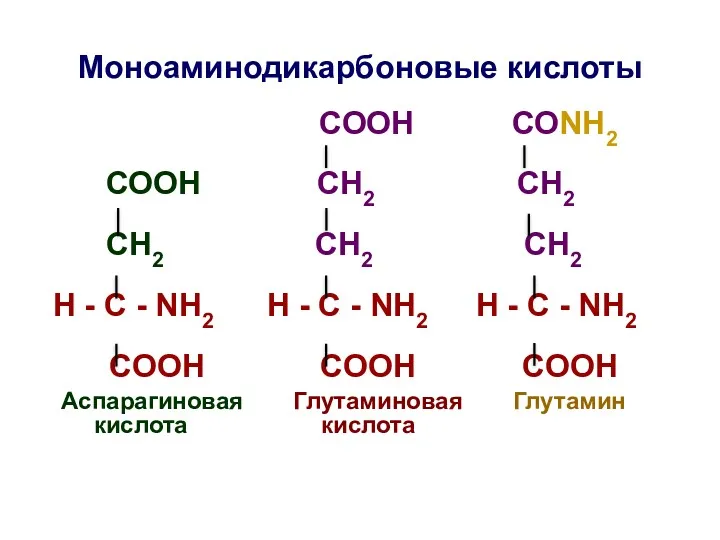
- 19. Моноаминодикарбоновые кислоты СООН СОNH2 СООН СН2 СН2 СH2 СН2 СН2 H - C - NH2 H
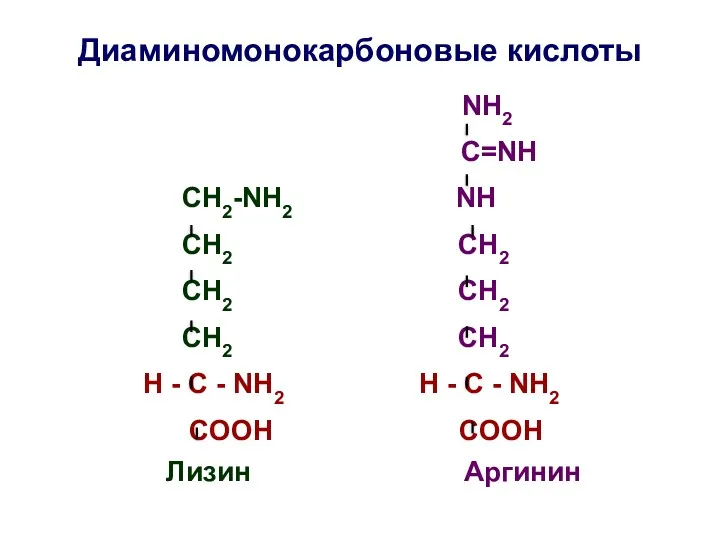
- 20. Диаминомонокарбоновые кислоты NH2 C=NH СН2-NH2 NH СH2 СH2 СН2 СН2 СH2 СН2 H - C -
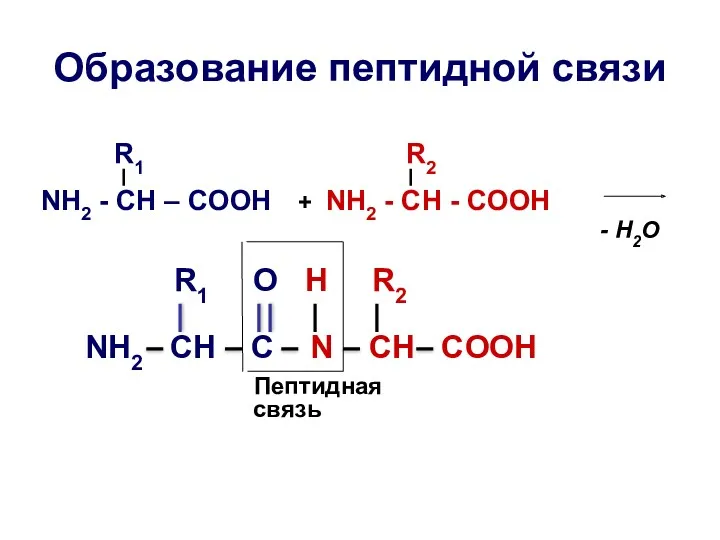
- 21. Образование пептидной связи R1 R2 NH2 - CH – COOH + NH2 - CH - COOH
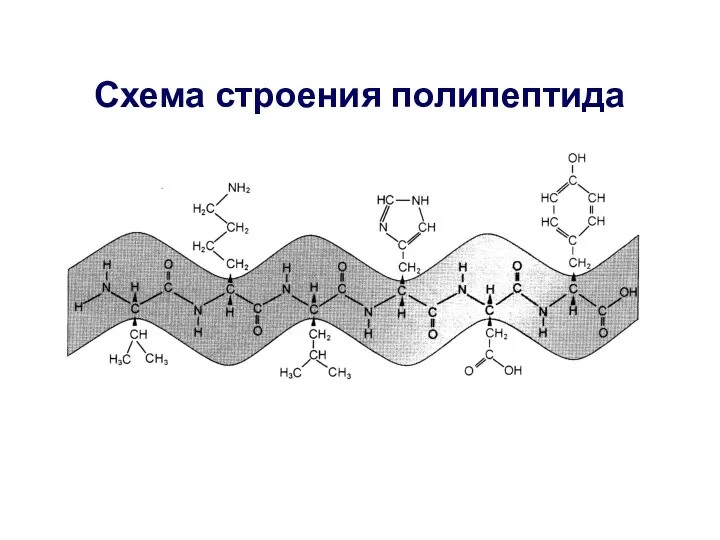
- 22. Схема строения полипептида
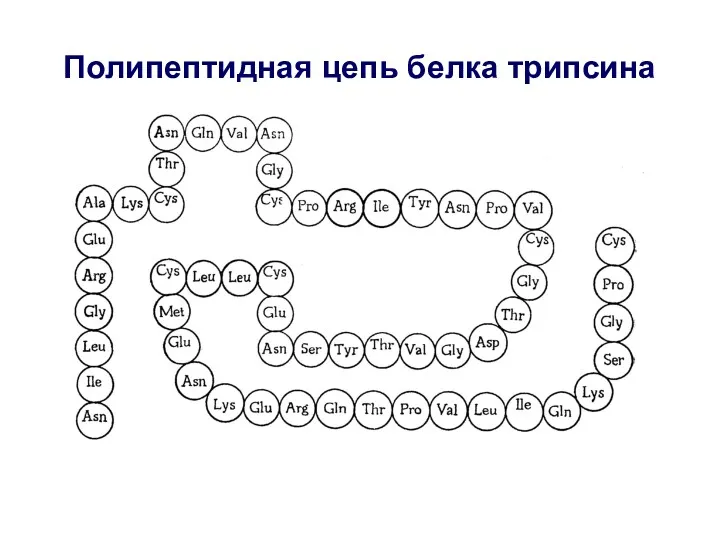
- 23. Полипептидная цепь белка трипсина
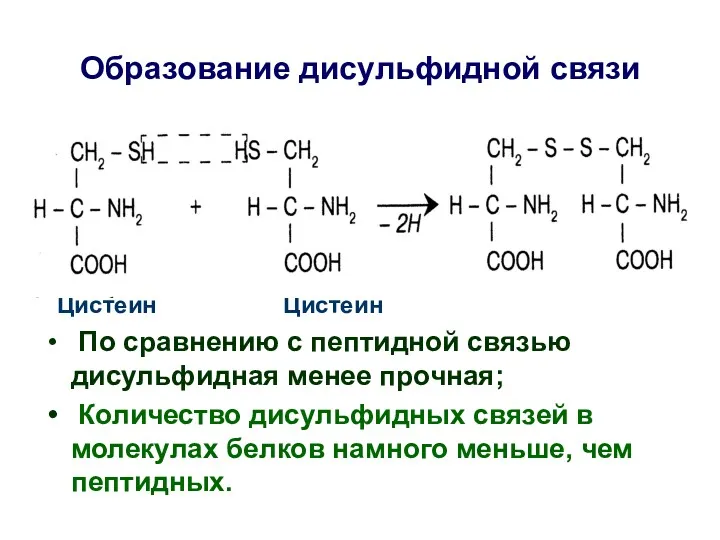
- 24. Цистеин Цистеин По сравнению с пептидной связью дисульфидная менее прочная; Количество дисульфидных связей в молекулах белков
- 25. Дисульфидные связи в молекуле белка-фермента РНК-азы
- 26. Дисульфидные связи в молекуле инсулина
- 27. Участок молекулы коллагена
- 28. Молекулярная масса белков Инсулин - 6000 Да (гормон поджелудочной железы) Миоглобин– 17000 Да (белок мышц) Гемоглобин
- 29. Пространственная форма белковых молекул Молекулы белков представляют собой объемные трехмерные образования и имеют сложную пространственную форму;
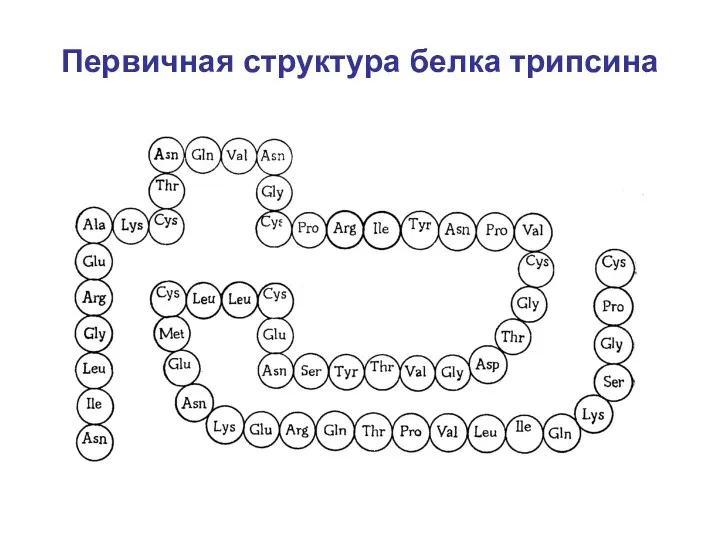
- 30. Первичная структура Первичная структура представляет собой последовательность расположения аминокислот в полипептидных цепях; Фиксируется первичная структура прочными
- 31. Первичная структура белка трипсина
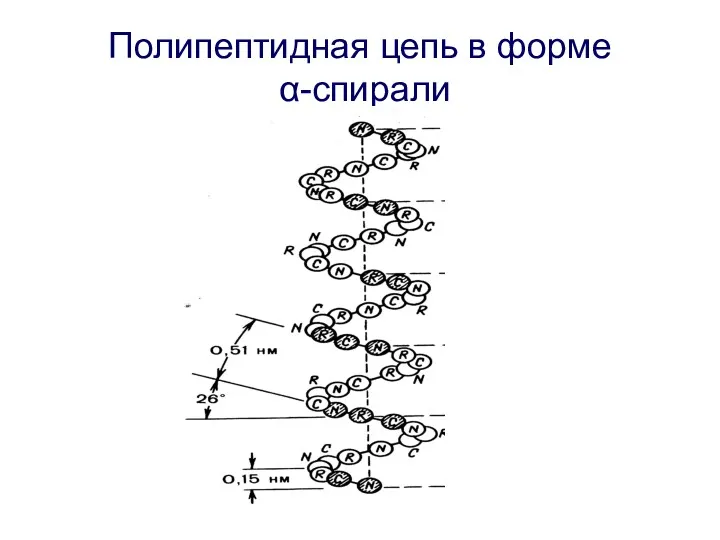
- 32. Вторичная структура Вторичная структура характеризует пространственную форму полипептидных цепей; Часто полипептидные цепи в белковых молекулах закручиваются
- 33. Полипептидная цепь в форме α-спирали
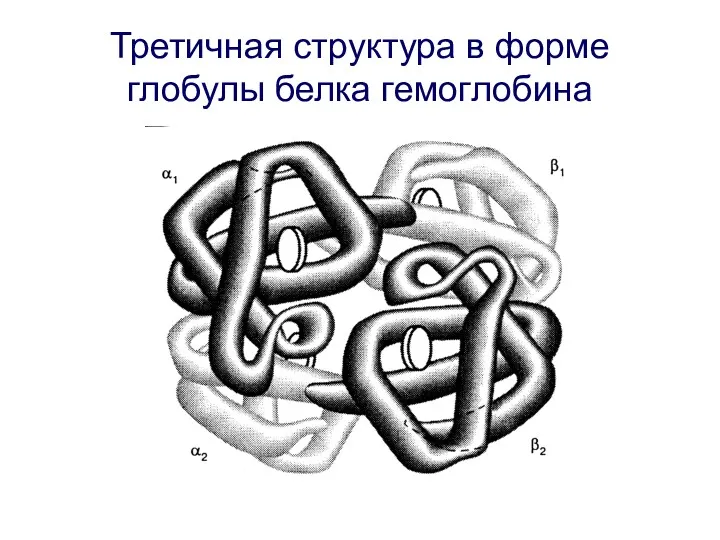
- 34. Третичная структура Третичная структура отражает пространственную форму вторичной структуры. Например, вторичная структура в форме спирали может
- 35. Третичная структура в форме глобулы белка гемоглобина
- 36. Конформация белка Пространственная форма всей белковой молекулы, являющаяся совокупностью первичной, вторичной и третичной структур обозначается термином
- 37. Четвертичная структура Четвертичной структурой обладают только некоторые белки; Четвертичная структура – сложное надмолекулярное образование, состоящее из
- 38. Субъединицы объединяются в четвертичную структуру только за счет слабых нековалентных связей, и поэтому четвертичная структура неустойчива.
- 39. Объединение субъединиц в четвертичную структуру приводит к возникновению нового биологического свойства, отсутствующего у отдельных субъединиц; Образование
- 40. Схема строения белковой молекулы, обладающей четвертичной структурой
- 41. Из всех структур белковой молекулы кодируется только первичная; За счет информации, заключенной в молекуле ДНК, синтезируются
- 42. Классификация белков (по химическому составу) БЕЛКИ Простые белки Сложные белки (протеины) (протеиды) 1. Альбумины 1. Фосфопротеиды
- 43. Классификация белков (по форме молекул) БЕЛКИ Глобулярные Фибриллярные 1. Альбумины 1. Коллаген 2. Глобулины 2. Кератины
- 44. Тест 1 Содержание белков в организме взрослого человека составляет: а) 8-10 % б) 15-17 % в)
- 45. Тест 2 Обязательным химическим элементом, входящим в состав белков, является: а) азот б) кальций в) селен
- 46. Тест 3 Во все белки входят: а) 10 разновидностей аминокислот б) 20 разновидностей аминокислот в) 30
- 47. Тест 4 В состав аминокислот обязательно входят функциональные группы: а) альдегидная и спиртовая б) карбоксильная и
- 48. Тест 5 Главной химической связью в белках является: а) водородная б) дисульфидная в) ионная г) пептидная
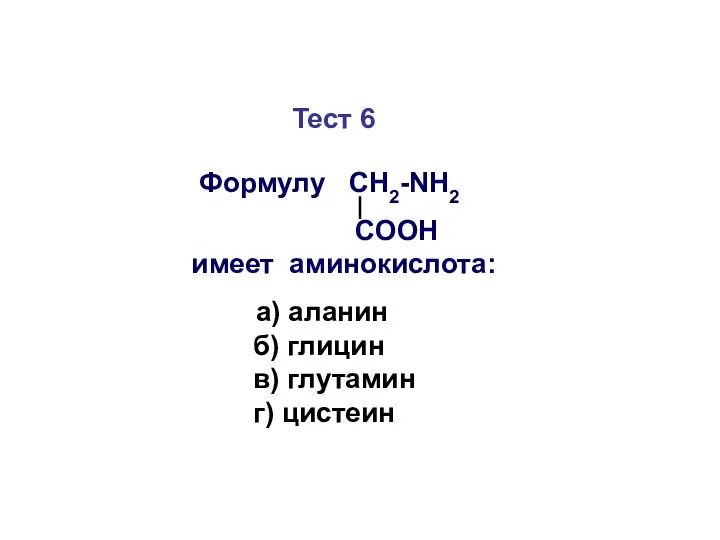
- 49. Тест 6 Формулу СН2-NH2 COOH имеет аминокислота: а) аланин б) глицин в) глутамин г) цистеин
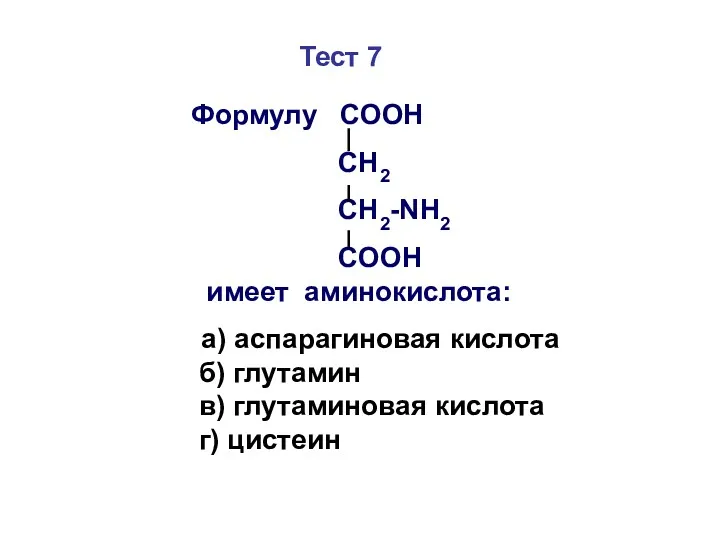
- 50. Тест 7 Формулу СООН СН2 СН2-NH2 COOH имеет аминокислота: а) аспарагиновая кислота б) глутамин в) глутаминовая
- 51. Тест 8 В образовании дисульфидной связи участвует аминокислота: а) аланин б) глицин в) глутамин г) цистеин
- 52. Тест 9 Первичная структура белковой молекулы фиксируется: а) водородными связями б) дисульфидными связями в) ионными связями
- 53. Тест 10 Простые белки отличаются от сложных: а) молекулярной массой б) отсутствием дисульфидных связей в) отсутствием
- 54. Тест 11 Cложные белки отличаются от простых: а) изоэлектрической точкой б) наличием дисульфидных связей в) наличием
- 56. Скачать презентацию






































 Катионы IV аналитической группы
Катионы IV аналитической группы Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Классификация веществ
Классификация веществ Как трудно быть особенной…
Как трудно быть особенной… Химическое равновесие
Химическое равновесие Химические свойства алкенов
Химические свойства алкенов Геология полезных ископаемых
Геология полезных ископаемых Цікаві факти про хімію
Цікаві факти про хімію Электронная природа химической связи. Кристаллические и аморфные вещества
Электронная природа химической связи. Кристаллические и аморфные вещества Electron Structure
Electron Structure Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Хімічні та фізичні явища
Хімічні та фізичні явища Строение атома и периодический закон
Строение атома и периодический закон Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Процесс электролиза
Процесс электролиза Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Водород
Водород Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Природные источники углеводородов и топливные ресурсы Западной Сибири
Природные источники углеводородов и топливные ресурсы Западной Сибири Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Водород
Водород