Содержание
- 2. Цель урока: Изучить сущность процесса электролиза и выяснить области его применения.
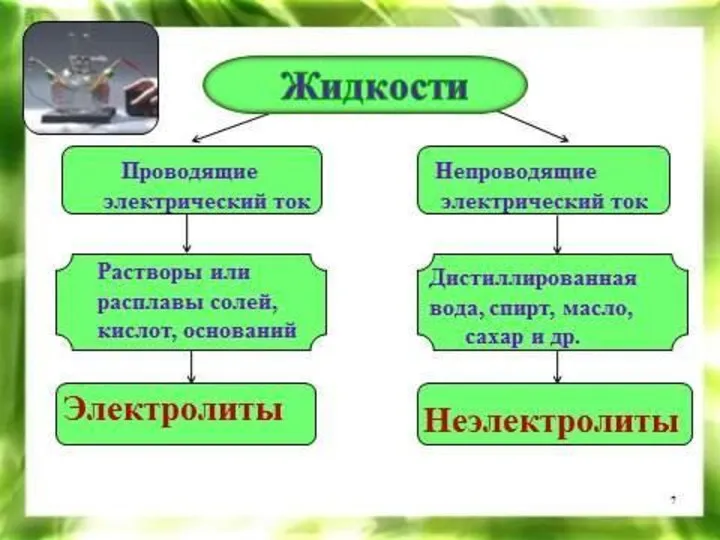
- 3. “Электро” – электрический “лизис” – разложение Электролиз- окислительно – восстановительный процесс, протекающий на электродах при прохождении
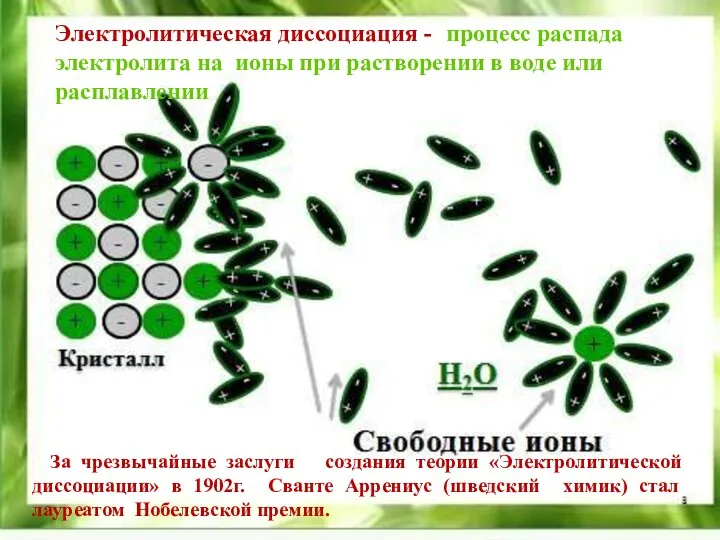
- 5. Электролитическая диссоциация -- процесс распада электролита на ионы при растворении в воде или расплавлении За чрезвычайные
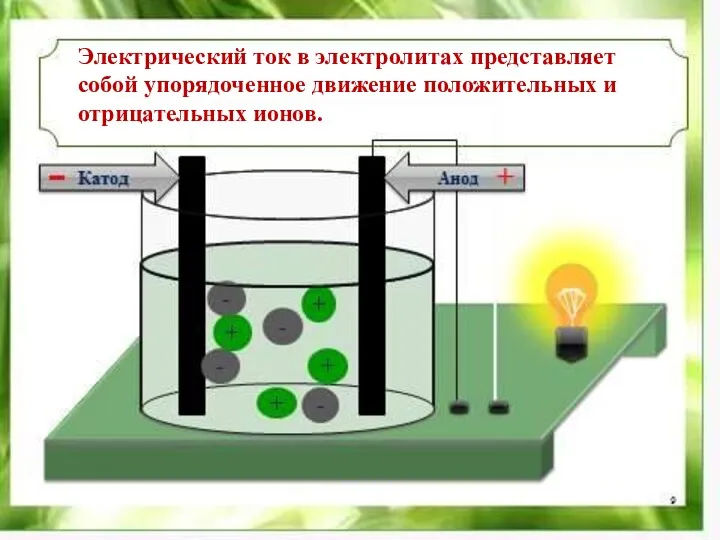
- 6. Электрический ток в электролитах представляет собой упорядоченное движение положительных и отрицательных ионов.
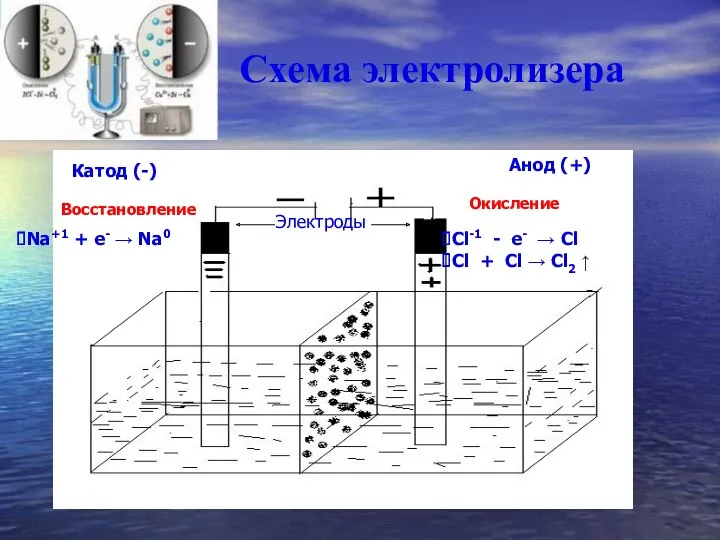
- 7. Схема электролизера Восстановление Окисление Катод (-) Анод (+) Электроды Cl-1 - e- → Cl Cl +
- 8. Электролиз расплава 2NaСI = 2Na + CI2 В 1886 г. французский химик Анри Муассан после многих
- 9. Электрометаллургия – это получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд.
- 10. «Где взять кислород в глубине межпланетного пространства? Думай! ….» Гарри Гаррисон «Космический врач»
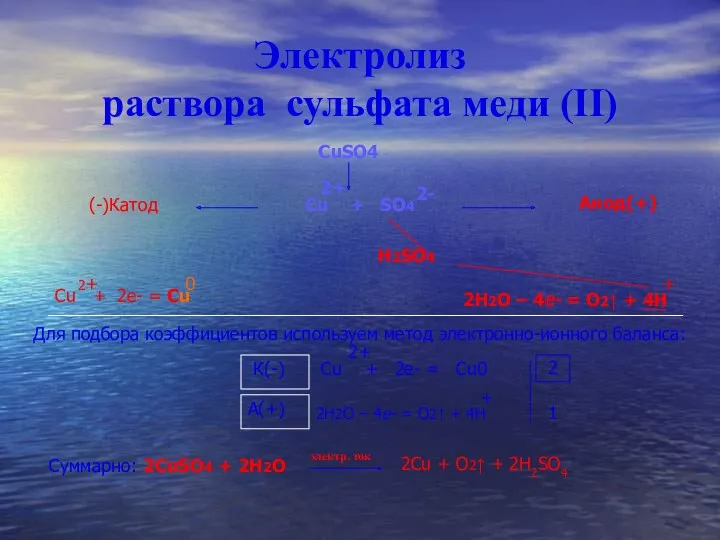
- 11. Электролиз раствора сульфата меди (II) электр. ток CuSO4 (-)Катод Cu + SO4 Анод(+) H2SO4 2H2O –
- 13. Система «Электрон» Электролиз воды на борту МКС
- 15. Рассчитайте массу меди, полученной при электролизе водного раствора сульфата меди c графитовыми электродами, если на аноде
- 16. Гальванопластика – это электролитическое изготовление металлических копий, рельефных предметов. Воссоздание роскошного убранства Кремлевского дворца
- 17. Электролитическое рафинирование- это очистка металлов от примесей с помощью электролиза, когда неочищенный металл является анодом, а
- 18. Гальваностегия – это декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение,
- 19. Архимед Величайший древнегреческий ученый, математик, физик и изобретатель (287 г. до н.э. – 212 г. до
- 20. Au + W
- 21. Итоговое тестирование 1.Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока? 2.На катоде происходит процесс
- 23. Скачать презентацию















 Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс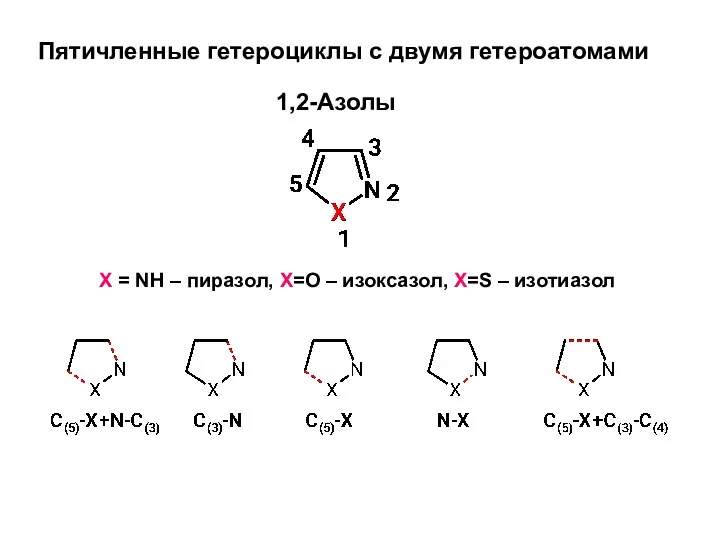 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами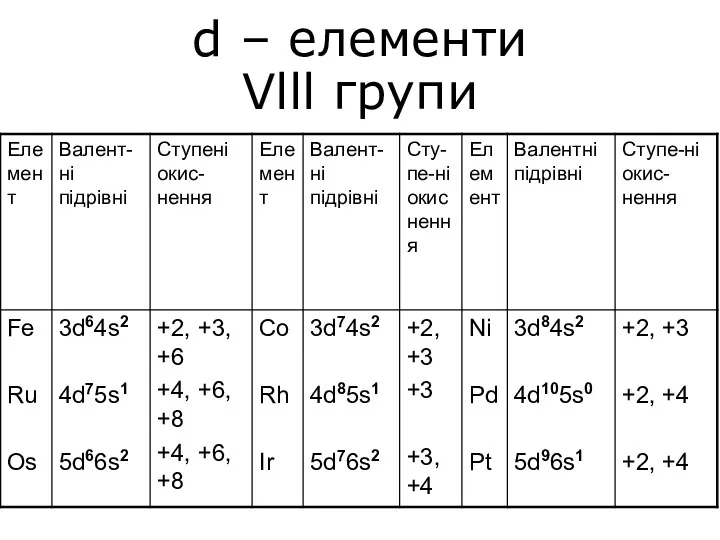 d – елементи Vlll групи
d – елементи Vlll групи Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Сероводород и сульфиды
Сероводород и сульфиды Понятие о солях (8 класс)
Понятие о солях (8 класс) Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Heavy metals
Heavy metals Валентность и степень окисления
Валентность и степень окисления Теоретические основы органической химии
Теоретические основы органической химии Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Молярный объем газов
Молярный объем газов Наноалотропи карбону: класифікація, одержання та застосування
Наноалотропи карбону: класифікація, одержання та застосування Фенолы
Фенолы Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Химиялық элементтердің табиғи топтары
Химиялық элементтердің табиғи топтары Вода. Растворимость, растворы
Вода. Растворимость, растворы Пищевые добавки
Пищевые добавки Хімічні властивості кисню. Реакції сполучення
Хімічні властивості кисню. Реакції сполучення Биологически важные вещества жиры
Биологически важные вещества жиры Полимеры и пластические массы
Полимеры и пластические массы Щелочные металлы
Щелочные металлы